题目内容
【题目】小缘为了探究温度对H2O2分解反应速率的影响,借助下图所示实验装置(夹持装置略去),进行了两次实验,两次实验的部分设计如表所示:

(1)写出实验中发生的化学反应的化学方程式:___________________,
(2)实验2中应加入5%H2O2__________________毫升;
(3)实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有_______________;
(4)实验结束后若将本实验中的二氧化锰经分离、干燥后称量,其质量为________g。二氧化锰在反应中的作用是_______作用。取用二氧化锰需要用_______(填“药匙”或“镊子”)。
【答案】 2H2O2![]() 2H2O+O2↑ 40 80℃比20℃时产生的水蒸气多 0.6 催化 药匙
2H2O+O2↑ 40 80℃比20℃时产生的水蒸气多 0.6 催化 药匙
【解析】由题中信息知,(1)实验中发生的化学反应的化学方程式:.2H2O2 ![]() 2H2O+O2↑。(2)实验2中应加入5%H2O2 40毫升。(3)实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有80℃比20℃时产生的水蒸气多。(4)实验结束后若将本实验中的二氧化锰经分离、干燥后称量,其质量为0.6 g,二氧化锰是该反应的催化剂,反应前后质量和化学性质均不变。二氧化锰在反应中的作用是催化作用。二氧化锰是粉末状固体,取用二氧化锰需要用药匙,镊子可用于取块状固体药品。
2H2O+O2↑。(2)实验2中应加入5%H2O2 40毫升。(3)实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有80℃比20℃时产生的水蒸气多。(4)实验结束后若将本实验中的二氧化锰经分离、干燥后称量,其质量为0.6 g,二氧化锰是该反应的催化剂,反应前后质量和化学性质均不变。二氧化锰在反应中的作用是催化作用。二氧化锰是粉末状固体,取用二氧化锰需要用药匙,镊子可用于取块状固体药品。
点睛∶影响H2O2分解反应速率的因素是温度和催化剂。

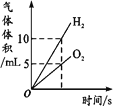
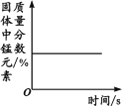
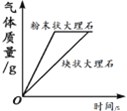
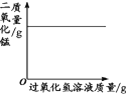
【题目】下列图像不能正确反映对应变化关系的是
|
|
|
|
A.将水通电电解一 段时间 | B.加热一定量的高 锰酸钾固体 | C.向两份相等质量的块状大理石和粉末状大理石中分别加入过量的等浓度的稀盐酸 | D.向一定量的二氧化锰中加入过氧化氢溶液 |
A. A B. B C. C D. D