题目内容
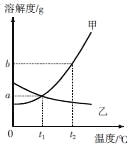
【题目】A、B、C三个烧杯中都盛有50g水(其中A、C烧杯中水温为10℃,B烧杯中水温为30℃,不考虑溶解过程中温度的变化),分别加入甲、乙(均不含结晶水)两物质各10g,充分搅拌后所得现象如下图所示,试回答:
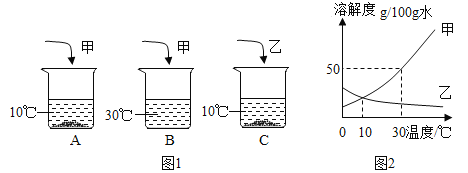
已知:甲、乙的溶解度随温度的变化如图所示
(1)30℃,甲物质的溶解度为_____。
(2)若要将B烧杯中的溶液变为饱和溶液,还需要加入物质甲_____克。
(3)从甲溶液中获取晶体的最佳方法是_____。
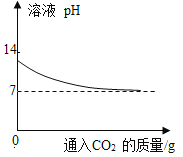
(4)10℃时,以上A、C烧杯中的溶液质量分数关系为A_____C(填“=”或“>”、“<”,下同)。若其他条件不变,将温度升高,则A、C烧杯中的溶液质量分数关系为A_____C。
(5)30℃,取等质量的甲、乙两种固体分别配成饱和溶液,需水质量较多的是_____(填“甲”或“乙”)。
【答案】50g/100g水 15 降温结晶 相等 A>C 乙
【解析】
(1)由溶解度曲线知30℃,甲物质的溶解度为50g/100g水;
(2)30℃甲物质的溶解度为50g,即100g水可溶解50g甲,故50g水可溶解25g甲,故若要将B烧杯中的溶液变为饱和溶液,还需要加入物质甲25g -10g =15g;
(3)因为甲的溶解度受温度影响较大,所以从甲溶液中获取晶体的最佳方法是降温结晶;
(4)根据溶解度曲线知,10℃时甲、乙的溶解度相同,根据图1可知,固体剩余,说明此温度下,甲、乙的溶解度大于10g/100g水,此时A、C两烧杯中的溶液都是饱和溶液,对于饱和溶液,溶质的质量分数=![]() ×100%,故A、C溶液中溶质的质量分数相等。若其他条件不变,将温度升高,由于甲物质的溶解度随温度的升高而增大,剩余固体溶解,溶液的质量分数变大,乙物质的溶解度随温度的升高而减小,升高温度会有晶体析出,溶解度不变,故A、C烧杯中的溶液质量分数关系为A>C;
×100%,故A、C溶液中溶质的质量分数相等。若其他条件不变,将温度升高,由于甲物质的溶解度随温度的升高而增大,剩余固体溶解,溶液的质量分数变大,乙物质的溶解度随温度的升高而减小,升高温度会有晶体析出,溶解度不变,故A、C烧杯中的溶液质量分数关系为A>C;
(5)30℃,甲的溶解度大于乙,溶解等质量的甲、乙两种固体分别配成饱和溶液,需水质量较多的是乙。

【题目】阅读下面材料,回答问题。
硫元素广泛存在于自然界中,在火山口附近有硫单质存在,地球表面的含硫化合物主要以矿物质形式存在,如石膏(CaSO42H2O)、芒硝(Na2SO410H2O)等。硫单质是一种淡黄色的固体,不溶于水,易溶于二硫化碳(CS2)。火山喷发时,部分硫元素转化成硫化氢气体;部分硫元素转化成二氧化硫和三氧化硫气体,二氧化硫在大气中易被氧化成三氧化硫,二氧化硫和三氧化硫溶于水,分别生成亚硫酸和硫酸。
(1)从物质类别和硫元素化合价角度,对硫及其化合物进行分类,根据表中物质组成规律,补充缺项。
物质类别 | 单质 | 氢化物 | 氧化物 | 酸 | 盐 |
化学式 | S | H2S | SO2 | H2SO3 | _____ |
SO3 | H2SO4 | Na2SO4 |
(2)结合材料中硫单质的性质分析,如果洗去粘在试管壁上的硫,应选用的试剂是____。
(3)硫化氢中硫元素的化合价为________;硫化氢的水溶液称为氢硫酸,氢硫酸露置在空气中与氧气发生置换反应,产生淡黄色沉淀,写出化学方程式_________;氢硫酸敞口放置在空气中,溶液的pH__(填“增大”“减小”或“不变”)。
(4)从物质类别的角度预测,下列物质与二氧化硫、三氧化硫均能发生化学反应的是_______(填序号)。
a O2 b NaOH c H2O d HCl
(5)H2SO3不稳定,易分解产生气体(与H2CO3类似)。写出稀硫酸与亚硫酸钠(Na2SO3)溶液发生复分解反应的化学方程式________。
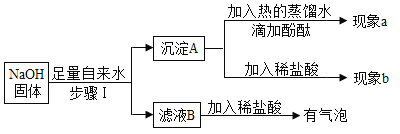
【题目】同学们在学碱的化学性质时,做了一个如图所示的甲乙两个实验。
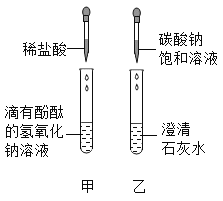
(1)写出乙实验的化学反应方程式_____,反应过程中产生的现象是_____。
实验结束后,甲、乙两个同学将废液倒入实验室的废液缸,结果发现废液浑浊并呈红色,产生疑问。
(提出问题)废液中含有哪些物质?
(交流讨论)①一定含有的物质:碳酸钙、指示剂、水和_____(写物质名称)。
②还含有能使废液呈碱性的物质。能使废液呈碱性的物质是什么?同学们有如下猜想。
小云认为:只有碳酸钠
小红认为:只有氢氧化钙
小林认为:是氢氧化钠和碳酸钠
你认为还可能是_____。(写一种猜想)
(实验设计)小方想用氯化钙溶液来验证小云、小红、小林的猜想。查阅资料获悉氯化钙溶液呈中性,并设计如下实验。请你将小方的实验设计补充完整。
实验内容 | 预计现象 | 预计结论 |
取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置。 | ①有白色沉淀,溶液呈红色。 | _____的猜想正确。 |
②_____。 | _____的猜想正确。 | |
③_____。 | _____的猜想正确。 |
(反思拓展)在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑_____。