题目内容
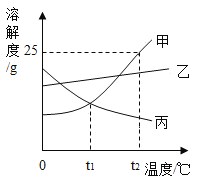
【题目】现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中均显+2价)。则下列说法错误的是
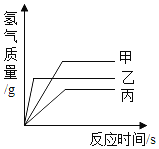
A.完全反应所需时间:丙>甲>乙B.生成氢气的质量:甲>乙>丙
C.相对原子质量:乙>丙>甲D.消耗硫酸的质量:甲>乙>丙
【答案】C
【解析】
A、由题意甲、乙、丙三种金属分别与三份溶质质量分数相同的足量稀硫酸反应,金属完全反应,根据生成氢气的质量与反应时间的关系图可知,金属乙反应的氢气质量最先达到最大值,其次是金属甲,最后是金属丙,即金属乙最先反应完,其次是金属甲,金属丙最后反应完,因此完全反应所需时间的关系为丙>甲>乙,A选项说法正确,不符合题意;
B、如图所示曲线平行于x轴时,生成的氢气质量达到最大值,三种金属生成氢气的质量甲最大,其次是乙,最小的是丙,即生成氢气的质量甲>乙>丙,B选项说法正确,不符合题意;
C、由题意已知甲、乙、丙在生成物中均显+2价,若金属元素的符号为M,与稀硫酸反应的通式为![]() ,设金属的相对原子质量为
,设金属的相对原子质量为![]() ,金属的质量为
,金属的质量为![]() ,生成氢气的质量为
,生成氢气的质量为![]() ,根据方程式可知
,根据方程式可知![]() ,则有
,则有![]() ,已知甲、乙、丙三种金属的质量相等,则金属的相对原子质量
,已知甲、乙、丙三种金属的质量相等,则金属的相对原子质量![]() 与生成氢气的质量成反比,如图所示生成氢气的质量关系为甲>乙>丙,三种金属的相对原子质量关系为甲<乙<丙,C选项说法错误,符合题意;
与生成氢气的质量成反比,如图所示生成氢气的质量关系为甲>乙>丙,三种金属的相对原子质量关系为甲<乙<丙,C选项说法错误,符合题意;
D、由题意已知甲、乙、丙在生成物中均显+2价,若金属元素的符号为M,与稀硫酸反应的通式为![]() ,由方程式可知生成的氢气中的氢元素全部来自于硫酸,根据质量守恒定律元素守恒,生成的氢气质量越大,消耗的硫酸质量越大,如图所示生成氢气的质量关系为甲>乙>丙,消耗硫酸的质量关系为甲>乙>丙,D选项说法正确,不符合题意。故选C。
,由方程式可知生成的氢气中的氢元素全部来自于硫酸,根据质量守恒定律元素守恒,生成的氢气质量越大,消耗的硫酸质量越大,如图所示生成氢气的质量关系为甲>乙>丙,消耗硫酸的质量关系为甲>乙>丙,D选项说法正确,不符合题意。故选C。

【题目】兴趣小组设计实验探究氢氧化钠的性质,请你参与他们的探究。
(实验过程与分析)
实验一 | 实验二 | 实验三 | |
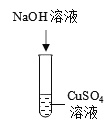
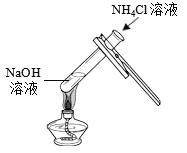
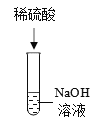
实验操作 |
|
|
|
实验现象 | __________ | __________ | 无明显现象 |
实验结论 | 氢氧化钠能与硫酸铜发生反应 | 氢氧化钠能与氯化铵发生反应 | 氢氧化钠不能与硫酸发生反应 |
(1)实验一的现象:___________。
(2)实验二的现象:__________。
(实验反思与拓展)
(3)实验一中发生反应的化学方程式: _____。
(4)某同学认为实验三的结论不正确,他改进了该实验方案:先向氢氧化钠溶液中滴入几滴酚酞溶液并振荡,再滴入稀硫酸,观察到溶液由____色变为无色,由此可知氢氧化钠与稀硫酸确实发生了反应,该反应的化学方程式为__________。
(5)由实验三联想到二氧化碳通入到氢氧化钠溶液中也没有明显现象,那么二氧化碳与氢氧化钠是否发生了化学反应呢? (本实验中忽略CO2溶于水)
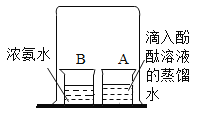
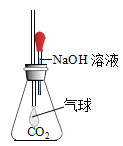
①甲同学设计了如图所示实验方案,当观察到_________现象时,说明两者发生了化学反应。
②乙同学重新设计实验方案:取NaOH溶液于试管中,通入少量CO2,然后向所得溶液中加入____溶液,当观察到_____现象时,也能证明二氧化碳与氢氧化钠发生了化学反应。