题目内容
【题目】水与人类的生活和生产密切相关,请回答下列问题:
(一)在农村人们常常饮用河水,河水中常含有大量的泥沙、悬浮物和细菌等杂质,一般可用次氯酸杀死细菌。将漂白粉(主要成分是次氯酸钙)溶于水可生成氯化钙和次氯酸.下列是某户居民在饮用水之前对河水的处理步骤:河水→A(加入明矾)→B(沉淀)→C(过滤)→D(加入漂白粉)→净水
(1)A步中加明矾的作用是_________________;
(2)该农户得到的净水是__________(填纯净物或混合物),原因是________________;
(3)在日常生活中,人们常用_________的方法来降低水的硬度;
(4)进行过滤操作时,下列做法错误的是(_________)
A玻璃棒要靠在三层滤纸的一边 B漏斗下端的管口要紧靠烧杯的内壁
C滤纸的边缘要低于漏斗口 D液面高于滤纸边缘
(5)加入漂白粉可对水进行杀菌消毒,其有效成分是次氯酸钙[化学式为Ca(ClO)2]。次氯酸钙中氯元素的化合价是________。
(二)电解水实验揭示了水的组成。
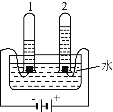
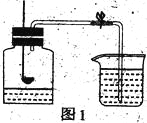
(1)如图实验中得到氧气的试管是 _______________(填“1”或“2”)。
(2)水电解的过程可用下图表示,微粒运动变化的先后顺序是(________)
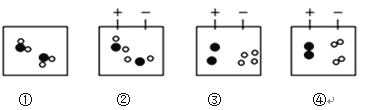
A①②③④ B④①③② C①②④③ D①④③②
(3)该反应属于_________(填基本反应类型),写出该反应的化学方程式_______________。
(4)该实验证明了水是由_______________ 组成的。
【答案】吸附悬浮的杂质,使杂质沉降 混合物 水中还有很多可溶性物质存在 煮沸 D +1 2 A 分解反应  氢元素和氧元素
氢元素和氧元素
【解析】
(一)(1)明矾可以吸附较大颗粒,加速沉降,加入明矾的作用是吸附悬浮的杂质,使杂质沉降;
(2)该农户得到的净化水是混合物,原因是水中还有很多可溶性物质存在;
(3)生活中通常采用加热煮沸的方法降低水的硬度,将水煮沸可以使水中的钙、镁离子沉淀;
(4)A、玻璃棒要靠在三层滤纸一侧,防止把滤纸划破,故A正确;
B、漏斗下端的管口要紧靠烧杯的内壁,从而加快过滤的速率,故B正确;
C、滤纸的边缘要低于漏斗口,防止液体从漏斗外壁流出,故C正确;
D、液面要低于滤纸的边缘,防止液体从滤纸和漏斗间流出,故D错误;
故填:D;
(5)![]() 中钙元素为+2价,氧元素为-2价,根据化合物中各元素化合价代数和为零的原则,设氯元素的化合价是x,可知次氯酸钙中氯元素的化合价:(+2)+2x+(-2)×2=0,则x=+1;
中钙元素为+2价,氧元素为-2价,根据化合物中各元素化合价代数和为零的原则,设氯元素的化合价是x,可知次氯酸钙中氯元素的化合价:(+2)+2x+(-2)×2=0,则x=+1;
(二)(1)电解水的实验装置可知,得到氧气的试管是2,收集的气体较少;
(2)由化学反应的实质可知,水电解的过程中微粒运动变化的先后顺序是:水分子分解成氢原子和氧原子,氢原子和氢原子结合成氢分子,氧原子和氧原子结合成氧分子,顺序是:①②③④,故填:A;
(3)水电解生成氢气和氧气,该反应的化学方程式为: ;反应物为一种,生成物为两种,该反应属于分解反应;
;反应物为一种,生成物为两种,该反应属于分解反应;
(4)该实验证明了水是由氢元素和氧元素组成的.