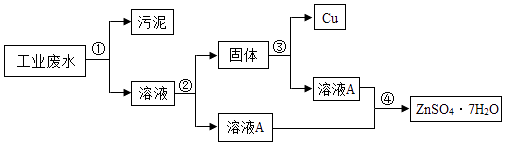
��Ŀ����
����Ŀ���ֻ����õĵ����﮵�أ�
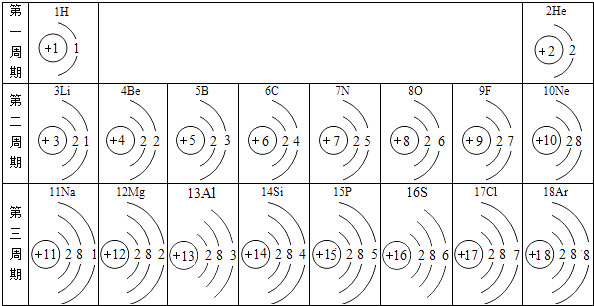
��1��С��ͬѧ��ﮣ�Li��Ԫ�ز�������Ȥ�����鿴��Ԫ�����ڱ���������ǽ������ʣ�ԭ�ӽṹʾ��ͼ�� �� �����˽��������ŵ��������˳����Ӧ�÷���ʲôλ�ã�������ȥ�����ʦ����ʦ�����Ƚ����þ������ƵĽ�����ԣ����������ﮡ�þ���ƵĽ������������룮
��2����������롿����һ��ﮡ�þ���ƵĽ��������ﮣ��ƣ�þ�� �����������þ���ƵĽ���������ƣ�ﮣ�þ��
��������ﮡ�þ���ƵĽ���������ƣ�þ��ﮣ�
��ʵ��̽����
ʵ����� | ʵ������ | ���� |
�����һ�����﮿��þ��ֱ������ͬŨ�ȵ������� | ������ᷴӦ�����ң������������ʸ��� | ��������������þ |
д��������ᷴӦ�Ļ�ѧ����ʽ��
��3��������̽����С��ͬѧ��Ϊ�ƺ�﮵Ľ�����Բ���Ҫʵ��Ҳ���ж�����Ϊ�ṹ�������ʣ����о����ƺ�﮵�ԭ�ӽṹʾ��ͼ����Ϊ���������������ƣ������� ��
��4�������۽������ۺ�ʵ�������̽�������Եó�����������ͬѧ�Ƕ�ԭ�ӽṹʾ��ͼ���������о������ִ�ԭ�ӽṹʾ��ͼ�����Ƴ�Ԫ�صĻ��ϼۣ�֪������Ԫ�����ۣ����������û��ϼ����ж�������ԭ��Ӧ����ѧ��Ӧ����Ԫ�ػ��ϼ������ľ�һ����������ԭ��Ӧ�����з�Ӧ����������ԭ��Ӧ����֪ˮ�е���Ԫ�غ���Ԫ�صĻ��ϼ�û�б仯�� A�����ʣ�+H2O=B�������+C�������
��ش�A������������ǽ����������ʣ�ԭ���� ��
���𰸡�
��1��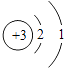
��2������2Li+2HCl=2LiCl+H2��
��3��������ԭ�ӵĺ�����Ӳ������ԭ�Ӷ�һ�㣬�ʸ���ʧȥ����
��4�������ǽ�������������AԪ�صĻ��ϼ�������Ҳ�н���
���������⣺�ԭ�ӽṹʾ��ͼΪ 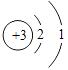 �����
����� 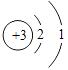 ����ʵ��̽����������ᷴӦ�����ң������������ʸ��죬˵��﮵Ļ��ǿ��þ��������� ������ᷴӦ�����Ȼ�﮺����������2Li+2HCl=2LiCl+H2����
����ʵ��̽����������ᷴӦ�����ң������������ʸ��죬˵��﮵Ļ��ǿ��þ��������� ������ᷴӦ�����Ȼ�﮺����������2Li+2HCl=2LiCl+H2����
������̽������Ϊ��ԭ�ӵĺ�����Ӳ������ԭ�Ӷ�һ�㣬�ʸ���ʧȥ���ӣ����ƵĻ��ǿ��ﮣ����������ԭ�ӵĺ�����Ӳ������ԭ�Ӷ�һ�㣬�ʸ���ʧȥ���ӣ�
�����۽���������ʵ��̽�����Կ���������þ���ƵĽ���������ƣ�ﮣ�þ���������
ˮ�е���Ԫ�غ���Ԫ�صĻ��ϼ�û�б仯������������AԪ�صĻ��ϼ�������Ҳ�м��ͣ���A�Ƿǽ���Ԫ�أ�����ǽ�������������AԪ�صĻ��ϼ�������Ҳ�н��ͣ�