题目内容
【题目】某工厂产生的废水中含有硫酸锌和少量的硫酸铜以及污泥,为了变废为宝,利用废水制取七水硫酸锌( ZnSO47H2 O),其工艺流程图如下: 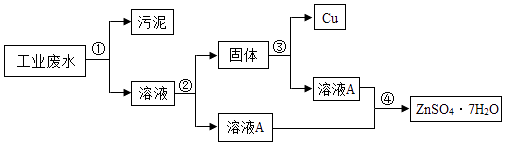
回答下列问题:
(1)步骤①的操作名称 .
(2)步骤②需如入过量的物质是 , 目的是 .
(3)步骤③需加入的溶液是 .
(4)步骤④的操作是蒸发浓缩, , 过滤.
(5)如果用ZnSO47H2O来配制100g 32.2%的硫酸锌溶液,需要g七水硫酸锌.
【答案】
(1)过滤
(2)锌;除去硫酸铜
(3)稀硫酸
(4)降温
(5)57.4
【解析】解:(1)步骤①的操作名称是过滤,通过过滤可以除去泥沙. 故填:过滤.(2)步骤②需如入过量的物质是锌,目的是除去硫酸铜.
故填:锌;除去硫酸铜.(3)步骤③需加入的溶液是稀硫酸,利用稀硫酸可以把锌转化成硫酸锌.
故填:稀硫酸.(4)步骤④的操作是蒸发浓缩,降温,过滤.
故填:降温.(5)设需要七水硫酸锌质量为x,
x× ![]() ×100%=100g×32.2%,
×100%=100g×32.2%,
x=57.4g,
故填:57.4.
【考点精析】解答此题的关键在于理解金属材料的选择依据的相关知识,掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属,以及对书写化学方程式、文字表达式、电离方程式的理解,了解注意:a、配平 b、条件 c、箭号.

 名校课堂系列答案
名校课堂系列答案【题目】手机常用的电池是锂电池.
(1)小华同学对锂(Li)元素产生了兴趣,他查看了元素周期表,发现锂是金属单质,原子结构示意图是 . 他想了解如果把锂排到金属活动性顺序中应该放在什么位置,于是他去请教老师,老师让他比较锂与镁和锂与钠的金属活动性.于是他针对锂、镁、钠的金属活动性提出猜想.
(2)【提出猜想】猜想一:锂、镁、钠的金属活动性是锂>钠>镁. 猜想二:铝、镁、钠的金属活动性是钠>锂>镁.
猜想三:锂、镁、钠的金属活动性是钠>镁>锂.
【实验探究】
实验操作 | 实验现象 | 结论 |
将体积一样大的锂块和镁块分别加入相同浓度的盐酸中 | 锂与盐酸反应更剧烈,产生气体速率更快 | 锂(填“>”或“<”)镁 |
写出锂与盐酸反应的化学方程式:
(3)【理论探究】小华同学认为钠和锂的金属活动性不需要实验也能判定,因为结构决定性质,他研究了钠和锂的原子结构示意图后认为锂(填“>”或“<”)钠,理由是 .
(4)【讨论交流】综合实验和理论探究,可以得出猜想成立.同学们对原子结构示意图进行深入研究,发现从原子结构示意图可以推出元素的化合价,知道金属元素无负价.还可以利用化合价来判定氧化还原反应,化学反应中有元素化合价升降的就一定是氧化还原反应.下列反应就是氧化还原反应,已知水中的氢元素和氧元素的化合价没有变化. A(单质)+H2O=B(化合物)+C(化合物)
请回答:A是(填“金属”或“非金属”)单质,原因是 .