题目内容
【题目】金属材料在生产、生活中的应用非常广泛,根据所学知识完成相关内容。
(1)吃火锅用的锅体是由铜合金制造的,主要是因为铜合金具有很好的_______(填字母)。
A.导电性 B.导热性 C.延展性
(2)金属锈蚀造成浪费。铁制品锈蚀的过程,实际上是铁与空气中的氧气、水发生化学反应的过程,写出一种防锈措施______________。
(3)目前世界上已有50%以上的废钢铁得到回收利用,其意义有__________(填字母)。
A.节约金属资源 B.合理开采矿物 C.减少废金属对环境的污染
(4)等质量的X、Y两种金属粉末分别和足量的同体积、同浓度的盐酸反应,产生气体的质量与时间的关系如图所示.下列说法中不正确的是_______(填字母)。
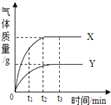
A. t1时,生成氢气的质量:X>Y
B.t2时,消耗金属的质量:X>Y
C.t3时,消耗盐酸的质量:X=Y
D.t3时,消耗金属的质量:X=Y
(5)某学习小组对过量炭粉与氧化铁反应后的气体产物成分进行研究。
【提出问题】学完完全燃烧与不完全燃烧后,知道碳在质量不同的氧气中燃烧可以生成二氧化碳或一氧化碳,那过量的炭粉与氧化铁反应后的气体产物有哪些可能呢?
【提出假设】假设1:只有二氧化碳;
假设2:_________________;
假设3:二氧化碳和一氧化碳的混合气体。
【设计方案】如下图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
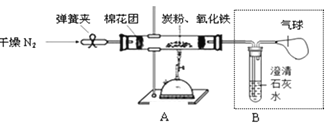
【查阅资料】氮气不与碳、氧化铁发生反应。实验室可以用氯化铵(NH4Cl)溶液和亚硝酸钠(NaNO2)溶液混合加热反应制得氮气,同时生成氯化钠和一种常见的液体。请写出该反应的化学方程式:_______________。
【实验操作及实验现象】
①按上图连接装置(未装药品),并检查装置的气密性,方法是先夹紧弹簧夹,在右侧导管处连接一注射器,将注射器活塞往里推一段距离,松手后观察到 __________现象,说明装置气密性良好。
②称取3.20g氧化铁和2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
③加热前,先通一段时间纯净干燥的氮气,目的是_______________。
④停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊,该现象说明______。
⑤待反应结束,应先___________,再_______________(填“熄灭酒精喷灯”或“打开弹簧夹、继续通氮气”),冷却至室温后停止通入氮气,称得硬质玻璃管和固体总质量为52.24g。(已知氧化铁被完全还原成铁单质)。
【数据处理】经计算,参加反应的碳元素质量为0.48g,生成的气体中碳元素与氧元素的质量比为___________(写出计算过程)。
【得出结论】根据数据处理结果判断,得出假设___________成立。
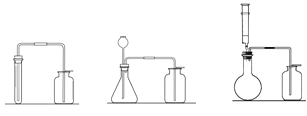
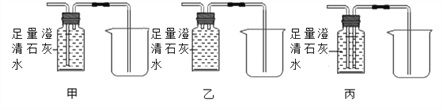
【实验反思】有同学认为也可以将上图中虚线内B装置换成以下装置,下列装置中你认为最为合理的是_________。
【答案】 B 刷漆 AC C 只有一氧化碳 NH4Cl +NaNO2 =N2↑+ NaCl + 2H2O 注射器又回到原来的刻度 排净装置中的空气,防止装置中空气里的氧气与碳反应 有二氧化碳生成假设2错误 【答题空10】熄灭酒精喷灯 继续通氮气 1:2 3 丙
【解析】本题考查了(1)金属的有关性质(2)根据实验现象和数据推断物质的组成,可根据质量守恒定律进行分析,实验操作部分可参考炼铁原理的操作。
(1)吃火锅用的锅体是由铜合金制造的,主要是因为铜合金具有很好的导热性,故选B;
(2)金属铁锈蚀造成浪费,隔绝氧气或隔绝水或隔绝水和氧气可防止铁锈蚀,例如刷漆等;
(3)废钢铁得到回收利用,其意义有节约金属资源、减少废金属对环境的污染,故选AC;
(4) A、根据图示可知,t1时,产生气体的质量是X>Y,正确;
B、t2时,X已反应结束,Y没有反应结束,消耗金属的质量:X>Y,正确;
C、t3时,产生气体的质量是X>Y,所以消耗盐酸的质量应该是X>Y,错误;
D、金属的质量相等,且盐酸是足量的,所以最后金属全部反应完。图示中t3 时刻两者的气体质量不再变化,说明金属已经完全反应,又金属的质量相等,所以消耗金属的质量X=Y,正确。故选C。
(5) 根据题中提供的信息和质量守恒定律可知:假设2:只有一氧化碳
【查阅资料】氮气不与碳、氧化铁发生反应。实验室可以用氯化铵(NH4Cl)溶液和亚硝酸钠(NaNO2)溶液混合加热反应制得氮气,同时生成氯化钠和一种常见的液体,根据质量守恒定律可知液体为水,该反应的化学方程式NH4Cl +NaNO2 ===== N2↑+ NaCl + 2H2O;
【实验操作及实验现象】
①先夹紧弹簧夹,在右侧导管处连接一注射器,将注射器活塞往里推一段距离,注射器中气体被压缩,压强增大,松手后观察到注射器又回到原来的刻度现象,说明装置气密性良好;
③加热前,先通一段时间纯净干燥的氮气,目的是排净装置中的空气,防止装置中空气里的氧气与碳反应;
④停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊,二氧化碳能使澄清石灰水变浑浊,该现象说明有二氧化碳生成假设2错误。
⑤待反应结束,应先熄灭酒精喷灯,再继续通氮气,以防止温度下降后硬质玻璃管中压强减小,石灰水倒流引起玻璃管炸裂,
【数据处理】在反应前后玻璃管中质量减少了48.48g+3.2g+2g-52.24g=1.44g,根据质量守恒定律可知,减少质量为参加反应的碳元素和氧元素的质量,参加反应的碳元素质量为0.48g,则参加反应的氧元素质量为1.44g-0.48g=0.96g,生成的气体中碳元素与氧元素的质量比为0.48g:0.96g=1:2;
【得出结论】在本实验中碳氧两元素的质量比为0.48g:0.96g=1:2,而在二氧化碳中碳氧元素的质量比为12:(16×2)═3:8,故不是纯的二氧化碳气体,假设1不成立,一氧化碳中碳氧元素的质量比为12: 16)═3:4,当气体产物为一氧化碳和二氧化碳混合物时,碳与氧的质量比应在3:4和3:8之间,1:2在3:4和3:8之间,所以气体产物为一氧化碳和二氧化碳,假设3成立;
【实验反思】上图中虚线内B装置作用是检验二氧化碳并能收集尾气,甲装置只能检验二氧化碳,尾气直接排放到空气中,乙装置中气体不能与澄清石灰水充分接触,当气体通入乙装置时,液体不能排出,所以不能收集尾气,当气体通入丙装置时,气体与澄清石灰水充分接触能检验二氧化碳,液体能排到烧杯中,尾气收集在瓶中,故选丙。

 名校课堂系列答案
名校课堂系列答案