题目内容
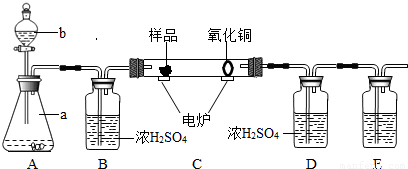
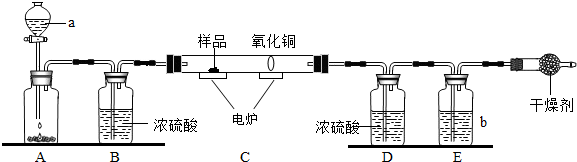
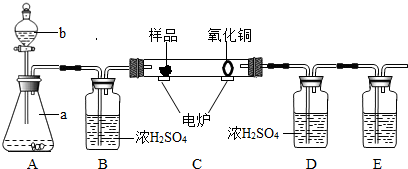
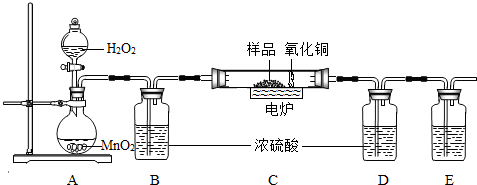
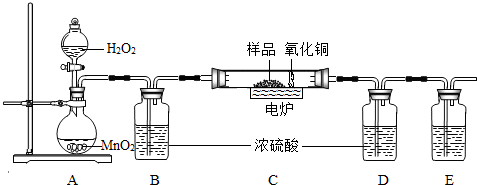
下图装置是用燃烧法来确定有机物组成的常用装置,这种方法是在电炉加热时用纯氧气氧化硬质玻璃管内样品,根据氧化产物的质量确定有机物的组成(在装置中C里的氧化铜是确保有机物中的碳元素完全转化为二氧化碳).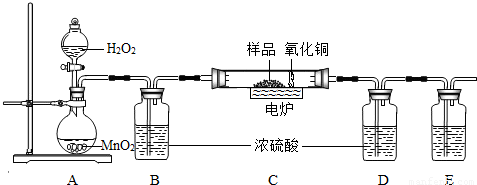
请回答有关问题:
(1)写出A装置中发生反应的化学方程式 .再写出用A装置制取另一种常见气体的化学方程式 .
(2)若去掉B装置会对 元素的测定结果有影响,会使测定结果 (填“偏大”或“偏小”).
(3)E装置中所盛放物质最好是 (选填:①石灰水;②NaOH溶液;③水).
(4)若准确称取1.12克样品(样品只含C、H、O三种元素中的两种或三种).经充分燃烧,D装置增重1.44克,E装置增重3.52克,则该有机物样品中所含的元素为 .
【答案】分析:(1)双氧水分解产生水和氧气,故可以写出该反应的化学方程式,在实验室中制取二氧化碳气体反应也不需要加热,可以据此解答;
(2)浓硫酸能够吸收水蒸气,结合过氧化氢分解产生的氧气会带出水蒸气来解答;
(3)根据氢氧化钙和氢氧化钠的溶解度来解答该题;
(4)根据相关方面的数据进行计算可以判断物质的元素组成.
解答:解:(1)根据题意可知:A中的反应为2H2O2 2H2O+O2↑,在实验室中制取二氧化碳也不需要加热,且是固体和固体反应,所以A装置也可以用来制取二氧化碳;
2H2O+O2↑,在实验室中制取二氧化碳也不需要加热,且是固体和固体反应,所以A装置也可以用来制取二氧化碳;
(2)根据题给的实验设计思路可知,B装置是用来吸收A中的水蒸气的,若去掉B装置,从A中挥发出来的水会进入D中,对氢元素的测量结果会有影响,将会使测得的氢元素的质量偏大;
(3)E装置中所盛放物质最好选用氢氧化钠溶液,因为氢氧化钠易溶于水,氢氧化钙微溶于水,氢氧化钠溶液可以完全吸收反应生成的二氧化碳;
(4)D装置增重1.44g,说明反应生成了1.44g水;E装置增重3.52g,说明反应生成了3.52g二氧化碳.
1.44g水中含有的氢元素的质量为:1.44g× ×100%=0.16g;
×100%=0.16g;
3.52g二氧化碳中碳元素的质量为:3.52g×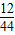 ×100%=0.96g;
×100%=0.96g;
结合质量守恒定律可以知道,有机物样品中碳元素和氢元素的质量和为:0.16g+0.96g=1.12g,与所称取的有机物的质量相等,故该样品中只含有碳元素和氢元素.
故答案为:
(1)2H2O2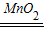 2H2O+O2↑;CaCO3+2HCl═CaCl2+H2O+CO2↑(其它合理答案也可);
2H2O+O2↑;CaCO3+2HCl═CaCl2+H2O+CO2↑(其它合理答案也可);
(2)氢(H);
(3)②;
(4)碳、氢(C、H).
点评:本题主要考查物质的性质和相关方面的计算等方面的知识,进行计算时不要漏掉百分号.
(2)浓硫酸能够吸收水蒸气,结合过氧化氢分解产生的氧气会带出水蒸气来解答;
(3)根据氢氧化钙和氢氧化钠的溶解度来解答该题;
(4)根据相关方面的数据进行计算可以判断物质的元素组成.
解答:解:(1)根据题意可知:A中的反应为2H2O2
 2H2O+O2↑,在实验室中制取二氧化碳也不需要加热,且是固体和固体反应,所以A装置也可以用来制取二氧化碳;
2H2O+O2↑,在实验室中制取二氧化碳也不需要加热,且是固体和固体反应,所以A装置也可以用来制取二氧化碳;(2)根据题给的实验设计思路可知,B装置是用来吸收A中的水蒸气的,若去掉B装置,从A中挥发出来的水会进入D中,对氢元素的测量结果会有影响,将会使测得的氢元素的质量偏大;
(3)E装置中所盛放物质最好选用氢氧化钠溶液,因为氢氧化钠易溶于水,氢氧化钙微溶于水,氢氧化钠溶液可以完全吸收反应生成的二氧化碳;
(4)D装置增重1.44g,说明反应生成了1.44g水;E装置增重3.52g,说明反应生成了3.52g二氧化碳.
1.44g水中含有的氢元素的质量为:1.44g×
 ×100%=0.16g;
×100%=0.16g;3.52g二氧化碳中碳元素的质量为:3.52g×
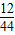 ×100%=0.96g;
×100%=0.96g;结合质量守恒定律可以知道,有机物样品中碳元素和氢元素的质量和为:0.16g+0.96g=1.12g,与所称取的有机物的质量相等,故该样品中只含有碳元素和氢元素.
故答案为:
(1)2H2O2
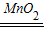 2H2O+O2↑;CaCO3+2HCl═CaCl2+H2O+CO2↑(其它合理答案也可);
2H2O+O2↑;CaCO3+2HCl═CaCl2+H2O+CO2↑(其它合理答案也可); (2)氢(H);
(3)②;
(4)碳、氢(C、H).
点评:本题主要考查物质的性质和相关方面的计算等方面的知识,进行计算时不要漏掉百分号.

练习册系列答案
相关题目
 2H2O+O2↑)
2H2O+O2↑)