题目内容
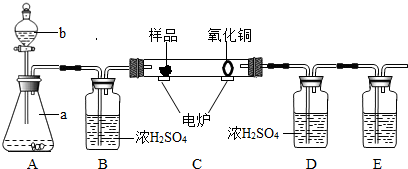
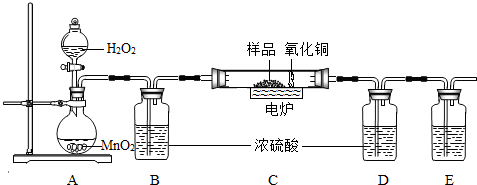
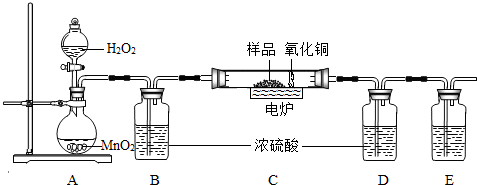
下图装置是用燃烧法来确定有机物组成的常用装置,这种方法是:在电炉加热时用纯净的氧气氧化管内样品,根据产物的质量确定有机物的组成(已知:C中的氧化铜是确保有机物中的碳元素完全转化为二氧化碳;A中的反应为2H2O2 2H2O+O2↑)
2H2O+O2↑)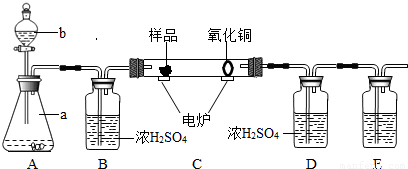
回答下列问题:
(1)A装置中a仪器的名称______,b中盛放的物质是______.
(2)若去掉B装置会对______元素的测量结果有影响.
(3)E装置中所盛放物质最好选用______(选填:①氢氧化钙溶液 ②氢氧化钠溶液 ③水).
(4)若准确称取1.12g样品(样品只含C、H、O三种元素中的两种或三种).经充分燃烧后,D装置增重1.44g,E装置增重3.52g,则该有机物样品中所含的元素为______.
【答案】分析:(1)熟记仪器名称,分析A中发生反应及反应物的状态:双氧水是液体;
(2)浓硫酸能够吸收水蒸气;
(3)氢氧化钙的溶解度很小,氢氧化钠的溶解度很大;
(4)根据相关方面的数据进行计算可以判断物质的元素组成.
解答:解:(1)结合课本可知该仪器为锥形瓶,根据题意:A中的反应为2H2O2 2H2O+O2↑,双氧水是液体,二氧化锰是固体,故填:双氧水;
2H2O+O2↑,双氧水是液体,二氧化锰是固体,故填:双氧水;
(2)分析实验设计思路可知,B装置是用来吸收A中的水蒸气,若去掉B装置,从A中挥发出来的水会进入D中,对氢元素的测量结果会有影响;
(3)E装置中所盛放物质最好选用氢氧化钠溶液,因为氢氧化钠易溶于水,氢氧化钙微溶于水,氢氧化钠溶液可以完全吸收反应生成的二氧化碳;
(4)D装置增重1.44g,说明反应生成了1.44g水;E装置增重3.52g,说明反应生成了3.52g二氧化碳.
1.44g水中含有的氢元素、氧元素的质量分别为:
1.44g×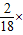 100%=0.16g,1.44g×
100%=0.16g,1.44g×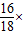 100%=1.28g.
100%=1.28g.
3.52g二氧化碳中碳元素的质量为:3.52g×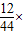 100%=0.96g.
100%=0.96g.
有机物样品中碳元素和氢元素的质量和为:0.16g+0.96g=1.12g.由此说明该样品中只含有碳元素和氢元素.
故答案为:
(1)锥形瓶,双氧水;
(2)氢;
(3)②;
(4)C、H 或 碳、氢.
点评:本题结合实验,让学生通过做题了解到测定物质组成的科学方法,有利于培养学生严谨的实验态度.
(2)浓硫酸能够吸收水蒸气;
(3)氢氧化钙的溶解度很小,氢氧化钠的溶解度很大;
(4)根据相关方面的数据进行计算可以判断物质的元素组成.
解答:解:(1)结合课本可知该仪器为锥形瓶,根据题意:A中的反应为2H2O2
 2H2O+O2↑,双氧水是液体,二氧化锰是固体,故填:双氧水;
2H2O+O2↑,双氧水是液体,二氧化锰是固体,故填:双氧水;(2)分析实验设计思路可知,B装置是用来吸收A中的水蒸气,若去掉B装置,从A中挥发出来的水会进入D中,对氢元素的测量结果会有影响;
(3)E装置中所盛放物质最好选用氢氧化钠溶液,因为氢氧化钠易溶于水,氢氧化钙微溶于水,氢氧化钠溶液可以完全吸收反应生成的二氧化碳;
(4)D装置增重1.44g,说明反应生成了1.44g水;E装置增重3.52g,说明反应生成了3.52g二氧化碳.
1.44g水中含有的氢元素、氧元素的质量分别为:
1.44g×
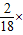 100%=0.16g,1.44g×
100%=0.16g,1.44g×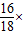 100%=1.28g.
100%=1.28g.3.52g二氧化碳中碳元素的质量为:3.52g×
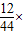 100%=0.96g.
100%=0.96g.有机物样品中碳元素和氢元素的质量和为:0.16g+0.96g=1.12g.由此说明该样品中只含有碳元素和氢元素.
故答案为:
(1)锥形瓶,双氧水;
(2)氢;
(3)②;
(4)C、H 或 碳、氢.
点评:本题结合实验,让学生通过做题了解到测定物质组成的科学方法,有利于培养学生严谨的实验态度.

练习册系列答案
相关题目