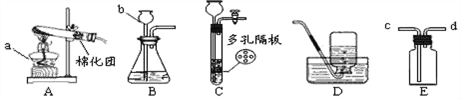
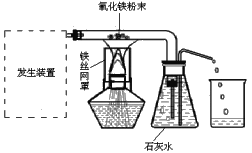
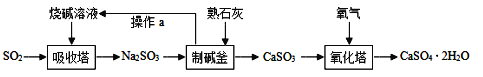
��Ŀ����
����Ŀ��ijͬѧ�����Ƶ�������ˮ��Ϊ�˼ӿ������ʣ�����ˮ�м�������������ǿ�䵼���ԣ�������93.6g��������Ϊ5%����������Һ��ͨ��һ��ʱ��������ϲ���3.2g�����������ϲ�����0.4g���������㣺
��1��������ˮ������Ϊ_________g��
��2����ͬѧ��Ϊ������ʽ������ּ�����ͨ������Һ�м��������ƣ���Ҫʹ��Һ�����ʵ�����������Ϊ10%������Ҫ���������ƹ���������Ƕ��٣�____��д��������̣�
���𰸡� 3.6g 4.8g
����������1�����������غ㶨�ɽ��
��2��������������������ʽ������
�⣺��1���������غ㶨�ɿ�֪��������ˮ������Ϊ3.2g+0.4g=3.6g
��2����Һ�������Ƶ�����Ϊ��93.6g��5%=4.68g,������Һ������Ϊ93.6g-3.6g=90g��
����������ƹ��������Ϊx��
![]() =10��
=10��
x=4.8g
����Ҫ���������ƹ����������4.8g��

 ����ѧ����ϵ�д�
����ѧ����ϵ�д�����Ŀ��ij�о�С����Զ���������ʾ��ͼ��ͼ����������̽����

[��������]���������ԭ���ǣ�ͨ������Һ�����ʹҺ�����ɫ��ĩ�Ӵ�����������̼���壬ʵ�������Զ�������
��1��Ϊ���������Ƕ�����̼����ѡ��_____�����Լ����ƣ���
̽��һ��Һ�������Һ����Ե�̽��
��2������ʱ����pH��ֽ�����Һ��pH=3�������Һ��_____�ԣ�
̽��������ɫ��ĩ�ɷֵ�̽��
[���������]��ͬѧ��Ϊ��̼��ƣ���ͬѧ��Ϊ��̼���ƣ���ͬѧ��Ϊ��̼�����ƣ�
[��Ʋ�����ʵ��]
��3����������ɫ��ĩ����ˮ�н��裬����ȫ���ܽ⣬˵����ͬѧ�IJ���______�����ȷ������ȷ������
��4������ʱ���ֱ���ʢ��̼�����ơ�̼���ƺͰ�ɫ��ĩ��Ʒ����ƿ��ע��������������10%���ᣨװ����ͼ2������¼�����
ʵ���� | ��ƿ������ | ���յõ�CO2���/mL | |
���� | ����/g | ||
�� | ̼������ | 0.10 | V1 |
�� | ̼���� | 0.10 | V2 |
�� | ��ɫ��ĩ | a | V1 |

ʵ��ٵĻ�ѧ����ʽΪ______________________������a=_____��V1_____V2�����������������=������
[����������]
��5�����ݱ���CO2�������ƿ�����������Ĺ�ϵ��ʵ�����ʵ�����ͬ���ɵó���ɫ��ĩ�ijɷ�Ϊ̼�����ơ�