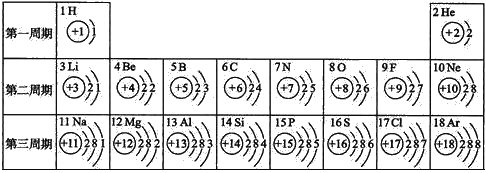
题目内容
【题目】我市著名的纸面石膏板企业,用热电厂燃烧煤产生的炉渣来生产石膏板。原理是:发电过程中产生的烟气中含有大量的SO2,热电厂用“碱﹣石灰﹣石膏(CaSO42H2O)”的方法使烟气脱硫从而生成石膏。
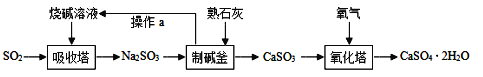
(1)工业烟气没经处理直接排放到空气中易形成_________,会污染、破坏环境。
(2)写出吸收塔内发生反应的化学方程式___________________________;
(3)生产流程中生成的_____________________可循环利用,节约成本。
【答案】 酸雨 SO2+2NaOH═Na2SO3+H2O NaOH(或烧碱溶液)
【解析】(1)根据二氧化硫的排放是导致酸雨形成的主要原因分析解答;
(2)根据氢氧化钠与二氧化硫反应,生成亚硫酸钠和水进行化学方程式的书写;
(3)根据流程图中吸收塔用氢氧化钠作原料而制碱釜中制得了氢氧化钠进行分析。
解:(1)工业烟气没经处理直接排放到空气中易形成酸雨,会污染、破坏环境;
(2)吸收塔内发生反应的化学方程式SO2+2NaOH═Na2SO3+H2O;
(3)吸收塔中消耗氢氧化钠,制碱釜中生成氢氧化钠,因此生产流程中生成的NaOH(或烧碱溶液)可循环利用,节约成本。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案【题目】溶解度的相对大小是判断物质溶解性的依据,请回答:
右图是a、b、c、d四种固体物质的溶解度曲线;下表是这些固体物质在部分温度时的溶解度。
NaCl | KCl | NH4Cl | KNO3 | |
10℃ | 35.8g | 31.0g | 33.3g | 20.9g |
60℃ | 37.3g | 45.5g | 55.2g | 110.0g |
(1)图中a曲线表示_____________(填物质名称)的溶解度曲线;若要从a与d的混合物中得到a,通常采用_________方法使其结晶。
(2)40℃时,比较a、c溶解度的大小:a ______(填“<”或“>”)c。要使a的饱和溶液变为不饱和溶液,除加水之外还可采用的方法是___________________。
(3)60℃时硝酸钾饱和溶液中溶质的质量分数约为__________。(计算精确到0.1%)
(4)60℃时配制100g硝酸钾饱和溶液,下图是配制过程的一些操作:
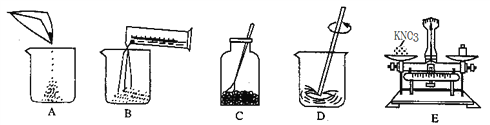
用序号A、B、C、D、E表示正确的实验操作顺序:__________________________;
称量时,分别在天平左右两盘放上纸片,调节平衡后,_________(填序号)。
A.先移动游码到所需要位置,再左盘添加硝酸钾直到天平平衡
B.先左盘添加所需要的硝酸钾,再右盘加砝码,移动游码直到天平平衡
C.先右盘加砝码,再移动游码,最后左盘加硝酸钾直到天平平衡