题目内容
【题目】海水是资源的宝库,海水淡化可获得淡水和浓海水.浓海水中主要离子的浓度如下:
离子 | Na+ | Mg2+ | Cl﹣ | SO42﹣ |
浓度/g/L | 63.7 | 28.8 | 144.6 | 46.4 |
从浓海水中提取金属镁的一段工艺流程如图所示:
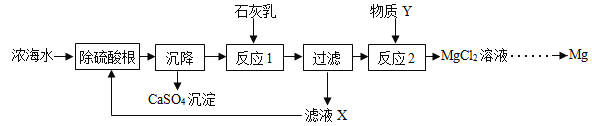
(1)补全由贝壳生产石灰乳的相应转化中所需的条件或反应物:
贝壳![]() 生石灰
生石灰![]() 石灰乳
石灰乳
(2)写出反应1的化学方程式: .
(3)滤液X中溶质的主要成分有 (填化学式).
(4)物质Y的名称是 .
(5)将MgCl2溶液在一定条件下蒸发结晶、熔融电解可制得金属镁.则2L浓海水理论上可得到金属镁的质量为 g.
【答案】
(1)煅烧;水;
(2)Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓;
(3)CaCl2;
(4)盐酸;
(5)57.6
【解析】
试题分析:(1)碳酸钙高温煅烧生成氧化钙,氧化钙与水反应生成氢氧化钙;故填:煅烧;水;(2)反应1是氢氧化钙与氯化镁发生复分解反应生成氯化钙和氢氧化镁白色沉淀;故填:Ca(OH)2+MgCl2= CaCl2+Mg(OH)2↓;(3)将物质过滤分离后所得溶液主要是氯化钙的溶液,故填:CaCl2;(4)酸碱中和生成盐和水,故加入的是稀盐酸,故填:盐酸;(5)化学反应前后元素的质量不变,因为1L浓海水中含有28.8g镁元素,那么2L浓海水中含有2×28.8g=57.6g镁元素.则理论上可得到金属镁的质量为57.6g.故填:57.6

练习册系列答案
相关题目