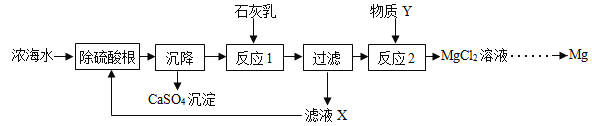
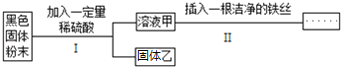
题目内容
【题目】要测定MgCl2(杂质是NaCl)的质量分数,取样品10g溶于100g水中,向其中加入50g NaOH溶于至恰好完全反应,得到沉淀5.8g.已知:MgCl2+2NaOH═Mg(OH)2↓+2NaCl,求:
(1)样品中MgCl2的质量分数.
(2)所用NaOH溶液的溶质质量分数.
【答案】95%;16%
【解析】
试题分析:
(1)设生成5.8g氢氧化镁沉淀时,消耗氯化镁的质量为x,氢氧化钠的质量为y
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
95 80 58
x y 5.8g
![]()
x=9.5g,y=8g
样品中MgCl2的质量分数为![]() =95%,
=95%,
(2)所用NaOH溶液的溶质质量分数为![]() =16%
=16%
答:(1)样品中MgCl2的质量分数为95%;(2)所用NaOH溶液的溶质质量分数为16%

 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】某品牌洁厕灵的成分是硫酸与盐酸的混合溶液.某课外活动小组想测定20g该品牌洁厕灵溶液中H2SO4和HCl的质量.取20g该品牌的洁厕灵溶液于烧杯中,不断滴加溶质质量分数为17.1%的氢氧化钡溶液,反应过程中烧杯中产生沉淀质量和烧杯中溶液pH变化的部分数据如下所示:

滴加氢氧化钡溶液的质量/g | 5 | 10 | 25 |
烧杯中产生沉淀的质量/g | 1.165 | 2.33 | 4.66 |
(已知BaCl2溶液的pH=7;Ba的相对原子质量137)
求:20g该品牌洁厕灵溶液中H2SO4的质量和HCl的质量.
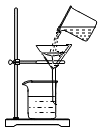
【题目】实验室部分装置如图所示,请回答下列问题。

(1)从图A中装置中任意选择一种仪器,写出它的名称: ,简要说出它的一种用途: 。
(2)从上图中选择发生和收集O2的装置,填写在下表中(填字母)。
选用药品 | 发生装置 | 收集装置 |
H2O2溶液、MnO2 | ||
KMnO4 |
(3)任意写出一个实验室里制取氧气的文字表达式或符号表达式: 。
(4)选用F装置收集气体时,下列实验操作正确的是 (填序号).
①反应前,将集气瓶注满水,用玻璃片盖着瓶口,倒立在盛水的水槽中
②开始反应后,等到气泡连续且均匀时,再将导管口移入集气瓶
③收集气体后,将集气瓶盖上玻璃片再移出水槽
(5)如何验证一瓶无色气体是氧气?
(6)如果用MnO2与浓硫酸(液体)加热制备O2,可选用上述发生装置是 (填字母)。
(7)实验结束后,要对实验仪器进行清洗,玻璃仪器洗涤干净的标志是 。