题目内容
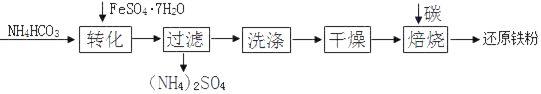
【题目】Ⅰ空气是一种用途很多的自然资源,可用于工业上制取氧气,其流程如下:
(查阅资料)常温下,氧气的沸点是-183℃,氮气的沸点是-196℃.
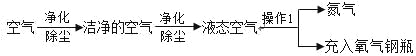
(1)操作 1 的名称是________________
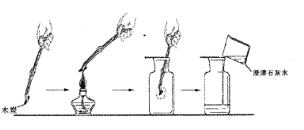
(2)如果将燃着的木条置于盛满液态空气的容器口,观察到的现象是木条_____(填“熄灭”或“燃烧更旺”),一段时间后,剩余液态物质的颜色逐渐变为______________色。
(3)除分离液态空气外,现在还有一种膜分离技术制氧气,原理是在一定压力下,让空气通过薄膜,氧气能透过薄膜,从而达到分离空气的目的。据此推测氮分子比氧分子体积_________(填“大”或“小”)
(4)下列属于氧气用途的是____________(填序号)
A.气体肥料 B.工厂炼制 C.充气包装 D.霓红彩灯
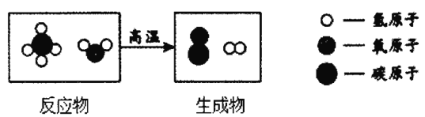
Ⅱ甲、乙、丙为初中化学上册中常见物质,它们之间均能一步实现如图所示的转化关系。

(1)如果丙能使带火星木条复燃,则甲的名称为_____,乙![]() 丙的基本反应类型是____________
丙的基本反应类型是____________
(2)如果乙是一种易与血液中的血红蛋白结合的有毒气体,则甲___________(填“肯定”或“可能”)是一种单质,若乙![]() 丙的反应现象之一是黑色变成亮红色,则化学方程式是__________
丙的反应现象之一是黑色变成亮红色,则化学方程式是__________
【答案】蒸发 熄灭 淡蓝色 大 B 过氧化氢 分解反应 可能 C+2CuO![]() 2Cu+CO2↑
2Cu+CO2↑
【解析】
Ⅰ(1)经操作 1后,由液态空气得到氮气和氧气,可知操作 1 是利用空气中各成分沸点不同来分离液态空气,故(1)操作 1 的名称是:蒸发
(2)分离液态空气制氧气,是利用液氧和液氮的沸点不同,液氮的沸点低,首先蒸发出来,氮气不支持燃烧,所以将燃着的木条置于盛满液态空气的烧杯口,观察到的现象是燃着的木条熄灭;液氮分离后,剩余的主要是液氧,液氧显淡蓝色。故一段时间后,剩余液态物质的颜色逐渐变为淡蓝色;
(3)由氧气能透过薄膜,从而达到分离空气的目的。说明氮分子比氧分子体积大;
(4) A、气体肥料是二氧化碳的用途,选项错误;
B、工厂炼制是氧气的用途,选项正确;
C、充气包装是氮气的用途,选项错误;
D、霓虹彩灯是稀有气体的用途,选项错误。故选B;
Ⅱ(1) 如果丙能使带火星木条复燃,则丙是氧气。又甲能转化为乙和丙且乙和丙能相互转化。则甲的名称为过氧化氢,乙为水,乙![]() 丙是水在通电的条件下分解生成氢气和氧气,该反应符合“一变多”的形式,故反应的基本反应类型是分解反应;
丙是水在通电的条件下分解生成氢气和氧气,该反应符合“一变多”的形式,故反应的基本反应类型是分解反应;
(2) 如果乙是一种易与血液中的血红蛋白结合的有毒气体,则乙是一氧化碳。又甲能转化为乙和丙且乙和丙能相互转化。则甲可能是碳或含碳的有机化合物,乙是一氧化碳,丙是二氧化碳, 故则甲可能是单质;若乙![]() 丙的反应现象之一是黑色变成亮红色,则可为碳与氧化铜的反应,方程式为 C+ 2CuO
丙的反应现象之一是黑色变成亮红色,则可为碳与氧化铜的反应,方程式为 C+ 2CuO![]() 2Cu + CO2↑ 。
2Cu + CO2↑ 。