题目内容
【题目】学习了酸和碱的化学性质后,同学们围绕“酸和碱的中和反应”开展了探究活动。请你参与学习并填写空格。
(1)李军同学将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中,一会儿后,发现忘记了滴加指示剂。于是他从烧杯中取出少量反应后的溶液于试管中,滴入几滴酚酞溶液,振荡,观察到无明显现象。此中和反应的化学方程式为。
(2)【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质组成是什么?
【假设猜想】针对疑问,大家纷纷提出猜想
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和
同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的是猜想。
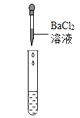
(3)【实验探究】为了验证其余猜想,同学们利用烧杯中的溶液,进行如下方案的探究。
实验方案 | 实验现象 | 结论与解释 |
| 溶液中有H2SO4 | |
| 溶液中有H2SO4 |
(4)【得出结论】通过探究,同学们一致确定猜想二是正确的。
【评价反思】老师对同学们能用多种方法进行探究给予了肯定,同时指出实验方案中有一个是错误的,错误的原因是。
【答案】
(1)H2SO4+2NaOH = Na2SO4+2H2O
(2)NaOH,猜想三
(3)产生大量气泡,产生白色沉淀
(4)方案二只能证明溶液中含有SO42-,不能证明含有H2SO4(合理即可)
【解析】(1)氢氧化钠和硫酸反应生成硫酸钠和水,方程式为H2SO4+2NaOH = Na2SO4+2H2O;
(2)NaOH 和硫酸刚好完全反应时反应后溶质只有硫酸钠;硫酸过量时溶质为硫酸和硫酸钠;氢氧化钠过量时溶质为:氢氧化钠和硫酸钠;滴入几滴酚酞溶液,振荡,观察到无明显现象,说明溶液不显碱性。猜想三不合理;
(3)碳酸钠和硫酸反应生成二氧化碳,产生大量气泡; 硫酸根离子和钡离子结合会产生白色沉淀;
(4)硫酸钠和硫酸都能与氯化钡反应生成硫酸钡沉淀,故方案二只能证明溶液中含有SO42-,不能证明含有H2SO4(合理即可).
所以答案是:(1)H2SO4+2NaOH = Na2SO4+2H2O;(2)NaOH;猜想三;(3)产生大量气泡;产生白色沉淀;(4)方案二只能证明溶液中含有SO42-,不能证明含有H2SO4(合理即可).
【考点精析】解答此题的关键在于理解中和反应及其应用的相关知识,掌握中和反应:酸与碱作用生成盐和水的反应.