题目内容
【题目】利用纯净、干燥的氢气还原灼热的氧化铜来测定水的组成.实验装置由A、B、C、D组成(氢气发生装置省略未画出).回答下列问题:
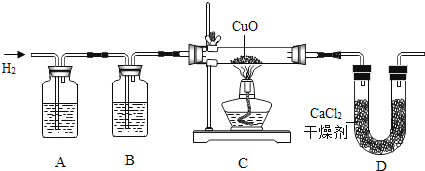
(1如果某学生用锌和较浓的盐酸制取氢气,他用装置A、B是为了得到纯净、干燥的氢气,在装置A中通常放 溶液,其作用是 ;在装置B中通常放 溶液,其作用是 .
(2)若实验前后,称量结果如下,装氧化铜的玻璃管的质量减少6、4克,装氯化钙的U型管的质量增加了7、2克.根据上述实验数据,写出水中氢、氧两种元素质量比的原始计算式 .
(3)在装置D中,将CaCl2改换为 ,才能检验出氢气还原氧化铜有水生成.
【答案】(1)氢氧化钠 氯化氢气体 浓硫酸 水蒸气
(2)(7.2g﹣6.4g)÷6.4g(3)无水硫酸铜
【解析】
运用氢气还原氧化铜生成水和铜,题中图示告诉我们氢气用锌和较浓的盐酸反应制得,故氢气中含有氯化氢气体和水蒸气,先要除去它们;水能使白色的无水硫酸铜变蓝色,所以用无水硫酸铜检验水;U形管减轻的质量是C中试管减轻的质量就是生成的水中氧元素的质量,D增重即生成的水的质量.故答案:(1)氢氧化钠 氯化氢气体 浓硫酸 水蒸气(2)(7.2g﹣6.4g)÷6.4g (3)无水硫酸铜

练习册系列答案
相关题目



