题目内容
(2013?市中区一模)某化学兴趣小组根据以下图示进行模拟炼铜的实验,并对产物成分进行探究.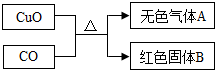
[提出问题]无色气体A有哪些成分?红色固体B可能是什么?
[猜想与假设]甲认为无色气体A一定是CO2,因为CO与CuO反应的化学方程式为
[交流与讨论]丙认为甲的猜想不一定正确,无色气体A除含CO2外,可能含CO,理由是
[探究与反思]
(1)为验证甲的猜想,大家按以下图示进行实验,过程和现象如下(箭头表示气体流向):
由此,你认为甲的猜想
(2)为验证乙的猜想,大家按以下图示进行实验探究,过程和现象如下: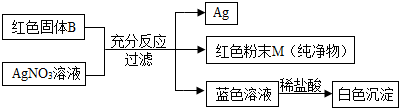
经过分析,大家确认乙的猜想是错误的,理由是(要求写出分析过程):
(3)为探究红色粉末M的组成,丁同学做了如下实验:
取洗净、烘干的7.2g红色粉末M,放在纯氧气流中加热,观察到粉末由红色逐渐变为黑色.充分反应,冷却、称量,质量为8.0g.将该黑色粉末放于足量稀硫酸中,黑色粉末全部溶解,得到蓝色溶液.大家分析、讨论、计算,最后得出红色粉末M的组成元素是

[提出问题]无色气体A有哪些成分?红色固体B可能是什么?
[猜想与假设]甲认为无色气体A一定是CO2,因为CO与CuO反应的化学方程式为
CO+CuO
Cu+CO2
| ||
CO+CuO
Cu+CO2
.乙认为红色固体B一定是Cu.
| ||
[交流与讨论]丙认为甲的猜想不一定正确,无色气体A除含CO2外,可能含CO,理由是
反应前后都要通入过量的一氧化碳;
反应前后都要通入过量的一氧化碳;
.[探究与反思]
(1)为验证甲的猜想,大家按以下图示进行实验,过程和现象如下(箭头表示气体流向):

由此,你认为甲的猜想
不正确
不正确
(选填“正确”或“不正确”).(2)为验证乙的猜想,大家按以下图示进行实验探究,过程和现象如下:

经过分析,大家确认乙的猜想是错误的,理由是(要求写出分析过程):
往蓝色溶液中加入稀盐酸,有白色沉淀,说明AgNO3溶液过量.当AgNO3溶液过量时,红色固体B中的Cu已经完全反应,可是还有红色粉末M存在,证明红色固体B除了Cu外,还有其他物质
往蓝色溶液中加入稀盐酸,有白色沉淀,说明AgNO3溶液过量.当AgNO3溶液过量时,红色固体B中的Cu已经完全反应,可是还有红色粉末M存在,证明红色固体B除了Cu外,还有其他物质
.(3)为探究红色粉末M的组成,丁同学做了如下实验:
取洗净、烘干的7.2g红色粉末M,放在纯氧气流中加热,观察到粉末由红色逐渐变为黑色.充分反应,冷却、称量,质量为8.0g.将该黑色粉末放于足量稀硫酸中,黑色粉末全部溶解,得到蓝色溶液.大家分析、讨论、计算,最后得出红色粉末M的组成元素是
Cu、O(或铜、氧)
Cu、O(或铜、氧)
,红色粉末M的化学式为Cu2O
Cu2O
.分析:【猜想与假设】由题目的信息可知:甲认为无色气体A一定是CO2,因为CO与CuO反应生成铜和二氧化碳;
【交流与讨论】丙认为甲的猜想不一定正确,根据一氧化碳还原金属氧化物的注意事项分析;
【探究与反思】(1)为验证甲的猜想,通过设计实验,观察现象表明:甲的猜想是不正确的.
(2)根据铜和硝酸银充分反应后仍有红色粉末的存在分析;
(3)通过探究猜想乙的流程图:可以判断红色物质B是铜和氧化亚铜,根据计算红色物质C是氧化亚铜.
【交流与讨论】丙认为甲的猜想不一定正确,根据一氧化碳还原金属氧化物的注意事项分析;
【探究与反思】(1)为验证甲的猜想,通过设计实验,观察现象表明:甲的猜想是不正确的.
(2)根据铜和硝酸银充分反应后仍有红色粉末的存在分析;
(3)通过探究猜想乙的流程图:可以判断红色物质B是铜和氧化亚铜,根据计算红色物质C是氧化亚铜.
解答:解:【猜想与假设】甲认为无色气体A一定是CO2,因为CO与CuO反应生成铜和二氧化碳,故答案为:CO+CuO
Cu+CO2;
【交流与讨论】丙认为甲的猜想不一定正确,无色气体A除含CO2外,可能含CO,理由是加热前需要通入一氧化碳来排净装置内的空气,防止加热时发生爆炸,反应后还要通入一氧化碳,防止铜重新被氧化;故答案为:反应前后都要通入过量的一氧化碳;
【探究与反思】
(1)为验证甲的猜想,通过设计实验,观察现象表明:甲的猜想是不正确的,二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀和水;故答案为:不正确;Ca(OH)2+CO2=CaCO3↓+H2O
(2)根据铜和硝酸银反应的规律分析,往蓝色溶液中加入稀盐酸,有白色沉淀,说明AgNO3溶液过量.当AgNO3溶液过量时,红色固体B中的Cu已经完全反应,可是还有红色粉末M存在,证明红色固体B除了Cu外,还有其他物质;
故答案为:往蓝色溶液中加入稀盐酸,有白色沉淀,说明AgNO3溶液过量.当AgNO3溶液过量时,红色固体B中的Cu已经完全反应,可是还有红色粉末M存在,证明红色固体B除了Cu外,还有其他物质;
(3)通过探究猜想乙的流程图解和质量守恒定律反应前后元素的种类不变可知:一氧化碳和氧化铜反应除了生成铜和二氧化碳外,还有的红色固体应该与铜的氧化物有关,铜的常见化合价是+1和+2,故红色粉末可能是氧化亚铜;7.2g红色粉末放在纯氧气流中加热,观察到粉末由红色逐渐变为黑色,充分反应,冷却、称量,质量为8.0g,说明该红色粉末结合了0.8g的氧,通过2Cu2O+O2
4CuO,7.2g的氧化亚铜恰好和0.8g的氧气反应生成8g的氧化铜,所以红色粉末是氧化亚铜,含有铜元素和氧元素,化学式为:Cu2O.
故答案为:铜、氧;Cu2O
| ||
【交流与讨论】丙认为甲的猜想不一定正确,无色气体A除含CO2外,可能含CO,理由是加热前需要通入一氧化碳来排净装置内的空气,防止加热时发生爆炸,反应后还要通入一氧化碳,防止铜重新被氧化;故答案为:反应前后都要通入过量的一氧化碳;
【探究与反思】
(1)为验证甲的猜想,通过设计实验,观察现象表明:甲的猜想是不正确的,二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀和水;故答案为:不正确;Ca(OH)2+CO2=CaCO3↓+H2O
(2)根据铜和硝酸银反应的规律分析,往蓝色溶液中加入稀盐酸,有白色沉淀,说明AgNO3溶液过量.当AgNO3溶液过量时,红色固体B中的Cu已经完全反应,可是还有红色粉末M存在,证明红色固体B除了Cu外,还有其他物质;
故答案为:往蓝色溶液中加入稀盐酸,有白色沉淀,说明AgNO3溶液过量.当AgNO3溶液过量时,红色固体B中的Cu已经完全反应,可是还有红色粉末M存在,证明红色固体B除了Cu外,还有其他物质;
(3)通过探究猜想乙的流程图解和质量守恒定律反应前后元素的种类不变可知:一氧化碳和氧化铜反应除了生成铜和二氧化碳外,还有的红色固体应该与铜的氧化物有关,铜的常见化合价是+1和+2,故红色粉末可能是氧化亚铜;7.2g红色粉末放在纯氧气流中加热,观察到粉末由红色逐渐变为黑色,充分反应,冷却、称量,质量为8.0g,说明该红色粉末结合了0.8g的氧,通过2Cu2O+O2
| ||
故答案为:铜、氧;Cu2O
点评:有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便.

练习册系列答案
相关题目

 (2013?市中区一模)水是生命之源,生产之要,生活之基.泉城市民更要珍惜水、节约水、保护水.请完成下列问题:
(2013?市中区一模)水是生命之源,生产之要,生活之基.泉城市民更要珍惜水、节约水、保护水.请完成下列问题: