题目内容
【题目】(10分)如图为“хх”钙片商品标签图,请根据标签的有关信息完成下列各题.
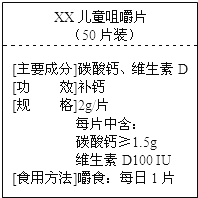
该钙片主要成分碳酸钙,碳酸钙的相对分子质量为 ① .
某校化学兴趣小组为了确认标签中碳酸钙的含量是否真实,决定通过实验进行探究.
实验目标:测定该钙片主要成分碳酸钙的含量.
实验原理:取一定质量的钙片与足量的稀盐酸反应,测量生成的CO2的质量(已知该状态下CO2的密度),然后计算其中碳元素的质量,利用反应前后碳元素的质量不变,再计算出碳酸钙的质量.
实验方案:兴趣小组的同学们经过思考提出了以下几种实验方案,请你参与他们对实验方案的讨论、取舍.
方案一:甲同学设计了如图所示的装置,通过反应后右侧注射器(注射器最大量程为20mL)内收集到气体的量来进行计算.
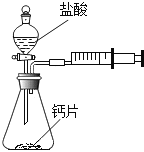
(1)同学们观看了他的设计后,都认为该方案中样品的取用的量需要一定的控制,这是因为 .
(2)同学们讨论后,一致认为注射器的摩擦会影响生成的CO2的完全收集.
方案二:乙同学设计了如图所示的装置,与甲同学的相比,仅仅在收集方法上不同.

(1)同学们观看了他的设计后,都认为所测得CO2气体的体积将会 ① (填偏大或偏小),你认为他们的理由是 ② ,你的改进方案是 ③ ;广口瓶内原有的空气对实验结果 ④ (填“有”或“没有”)影响.
(2)同学们讨论后,一致认为把装置改进后测得生成的CO2气体体积会偏大,你认为他们的最主要理由是 .
方案三:丙同学设计了如图所示的装置.同学们观看后一致认可他的设计,并按照他的思路设计了以下实验步骤.
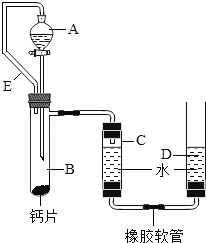
实验步骤:
①连接装置并检查装置气密性;
②加入10片钙片和水;
③记录C中液面刻度(C为带有刻度的玻璃管);
④由A向B中滴加稀盐酸至过量;
⑤待B中不再有气体产生并恢复至室温后,记录C中液面刻度,计算得到气体的体积为V mL(经查,该气体密度为ρg/L);
⑥计算气体的质量.
实验反思:
(1)丙同学在实验前将钙片全磨成粉末状,你认为他的目的是: ;
(2)检查该装置的气密性时,如图准备好装置,在C、D两管中装好水且液面相平,提高D管, ,则气密性良好;
(3)实验结论:经多次实验(钙片都是10片),所得CO2气体的平均质量是6.82g,请你最后计算确认标签中碳酸钙的含量是 (填“真实”或“不真实”)的.(最后一空不需要写计算过程)
【答案】①100
方案一:
(1)样品过多产生气体过多会导致注射器活塞被顶出;取样过少产生气体太少无法测量体积。(合理均可)
方案二:
(1)①偏小;
②理由是会有部分二氧化碳溶解在水中 ,
③在水面上滴一层植物油;
④没有
(2)滴入的盐酸有一定的体积,导致生成的气体体积偏大 .
方案三:
(1)使样品中的碳酸钙完全反应 ;
(2)液面静止后,C、D液面仍存在高度差 ,则气密性良好;
(3)真实
【解析】
试题分析:①碳酸钙的相对分子质量=40+12+(16×3)=100;
方案一:(1)采用注射器测量气体体积,样品过多产生气体过多会导致注射器活塞被顶出;取样过少产生气体太少无法测量体积;
方案二:
(1)①②二氧化碳会溶于水且与水反应;③可以隔绝气体与水的接触,如油封;④不与二氧化碳反应,没有影响;
(2)偏大说明排出的水偏多,即有其它的气体或者物质占据了空间,若气体的话要考虑盐酸的挥发性即有氯化氢气体,若其它物质则考虑加热盐酸溶液过多其占据的空间就不能忽略;
方案三:
(1)即增大了接触面积,可使反应充分;
(2)若气密性好,水就无法流动,即会产生高度差;结合得CO2气体的平均质量是6.82g和CaCO3 + 2HCl === CaCl2 + H2O + CO2↑可得CaCO3的质量为15.5g,那么每片含1.55g>1.5g。

【题目】在一密闭容器中加入甲、乙、丙、丁四种物质,一定条件下充分反应,反应前后的数据如下表。下列说法正确的是
物质的质量 | 甲 | 乙 | 丙 | 丁 |
反应前 | 25g | 8 g | X | 5g |
反应后 | 8g | 8g | 20g | 9g |
A.x=6g
B.甲的化学计量数等于丙和丁的化学计量数之和
C.乙物质一定是催化剂
D.该反应是分解反应
【题目】实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样。已知它是无色液体,是初中化学常用的试剂。小强和小华同学很感兴趣,决定对其成分进行探究:

【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是 。
A.酸 B.碱 C.盐
【查阅资料】
Ⅰ.初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
Ⅱ.Na2CO3和NaHCO3溶液都呈碱性。
Ⅲ.测定室温(20℃)时,四种物质的溶解度的数据如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
溶解度/g | 36 | 109 | 215 | 9.6 |
【得出结论】小华根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是 。
【作出猜想】①可能是 溶液;②可能是Na2CO3溶液;③可能是NaCl。
【设计并实验】
(1)小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能是 。
(2)小强为了检验该溶液是NaOH溶液还是Na2CO3溶液,他又进行了如下实验:
操作步骤 | 实验现象 | 结论及化学方程式 |
取样于试管中, 滴加氢氧化钙溶液 | 猜想②正确 相关的化学方程式 |