题目内容
【题目】实验考试结束后,小明在帮老师整理实验器材时发现盛放氢氧化钠溶液的试剂瓶忘记盖上瓶塞了,他对溶液是否变质产生了浓厚的兴趣,化学兴趣小组的同学们一起进行了如下探究:
猜想与假设
猜想1:该溶液没有变质 猜想2:该溶液部分变质 猜想3:该溶液完全变质
方案讨论
为了验证猜想2和猜想3,甲乙丙三位同学分别提出了如下方案:
甲:取少量样品溶液,向其中滴入酚酞溶液,若酚酞变红,则猜想2成立,否则猜想3成立。同学们认为此方案不行,原因是:_____
乙:取少量样品溶液,向其中滴入足量的氢氧化钡溶液,再滴入酚酞,根据不同的现象来判断猜想2或猜想3成立,同学们还是认为此方案不行,原因是:_____
丙:取少量样品溶液,向其中滴入足量的氯化钡溶液,再滴入酚酞,根据不同的想象来判断猜想2或猜想3成立,同学们分析认为此方案可行。
实验操作
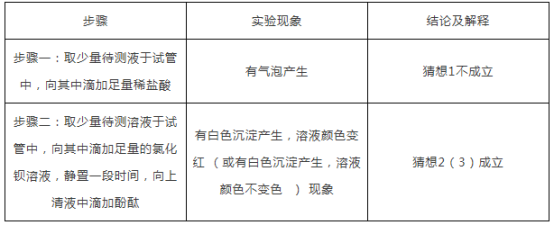
步骤 | 实验现象 | 结论及解释 |
步骤一:取少量待测液于试管中,向其中滴加足量稀盐酸 | 有_____产生 | 猜想_____不成立 |
步骤二:取少量待测溶液于试管中,向其中滴加足量的氯化钡溶液,静置一段时间,向上清液中滴加酚酞 | 有_____现象 | 猜想_____成立 |
反思与交流
(1)氢氧化钠溶液变质的原因:_____(用方程式表示);所以保存氢氧化钠必须_____;
(2)实验操作步骤一中用稀盐酸来检验氢氧化钠溶液是否变质,需加入足量或过量稀盐酸的原因是:_____;
(3)实验操作步骤二中加入足量的氯化钡溶液的目的是:_____,涉及到的化学反应原理是_____(用方程式表示)。
【答案】碳酸钠溶液也呈碱性,也能使酚酞溶液变红 加入氢氧化钡溶液会引进氢氧根离子,干扰氢氧化钠的检验 有气泡产生 猜想1不成立 有白色沉淀产生,溶液颜色变红或有白色沉淀产生,溶液颜色不变色 猜想2成立或猜想3成立 2NaOH+CO2==Na2CO3+H2O 密封保存 在氢氧化钠和碳酸钠同时存在时,加入盐酸要先与氢氧化钠反应,若加入盐酸的量很少,溶液中有碳酸钠也不会产生气泡,从而影响实验结果 将碳酸钠完全除去 BaCl2+Na2CO3===BaCO3+2NaCl↓
【解析】
方案讨论:
甲:由于碳酸钠溶液氢氧化钠溶液都显碱性,取少量样品溶液,向其中滴入酚酞溶液,若酚酞变红,则猜想2成立,否则猜想3成立。同学们认为此方案不行,原因是:碳酸钠溶液也呈碱性,也能使酚酞溶液变红。
乙:取少量样品溶液,向其中滴入足量的氢氧化钡溶液,再滴入酚酞,根据不同的现象来判断猜想2或猜想3成立,同学们还是认为此方案不行,原因是:加入氢氧化钡溶液会引进氢氧根离子,干扰氢氧化钠的检验。
实验操作:步骤一:由于碳酸钠能与稀盐酸反应生成了二氧化碳气体;
步骤二:要证明是否含有氢氧化钠,应先加入足量的氯化钡等将碳酸钠除去,再用酚酞试液检验溶液是否显碱性,所以实验如下:
反思与交流
(1)氢氧化钠溶液变质的原因是二氧化碳与空气中的二氧化碳反应生成了碳酸钠和水:2NaOH+CO2═Na2CO3+H2O;所以保存氢氧化钠必须密封保存;
(2)实验操作步骤一中用稀盐酸来检验氢氧化钠溶液是否变质,需加入足量或过量稀盐酸的原因是:在氢氧化钠和碳酸钠同时存在时,加入盐酸要先与氢氧化钠反应,若加入盐酸的量很少,溶液中有碳酸钠也不会产生气泡,从而影响实验结果;
(3)由于碳酸钠溶液显现碱性,干扰了氢氧化钠的检验,所以实验操作步骤二中加入足量的氯化钡溶液的目的是:将碳酸钠完全除去,涉及到的化学反应原理是:BaCl2+Na2CO3═BaCO3↓+2NaCl。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案