题目内容
【题目】“氧泡泡”系列产品去污能力强、绿色环保,已成为中国氧系清洁品类领导品牌,其主要成分是过碳酸钠(2Na2CO3·3H2O2)。某化学活动小组对过碳酸钠产生了浓厚的兴趣,决定对其进行探究。
【查阅资料】
Ⅰ.过碳酸钠在水中易离解成Na2CO3和H2O2,其水溶液具有Na2CO3和H2O2的双重性质;
Ⅱ.过碳酸钠能与盐酸反应:2(2Na2CO3·3H2O2)+8HCl=8NaCl+4CO2↑+3O2↑+10H2O;
Ⅲ.过碳酸钠的去污能力主要与其在反应中释放出的“活性氧”有关,“活性氧”含量越高,去污能力越强。
(1)20℃时,测得1%过碳酸钠水溶液的pH为10.5,说明其溶液呈______(选填”酸性”、“中性”或“碱性’" )。
(2)向过碳酸钠水溶液中加入少量MnO2时产生大量气泡,发生反应的化学方程式是_____ 。
(3)过碳酸钠样品中“活性氧”含量可按如下公式计算:
![]()
为测定某过碳酸钠样品中“活性氧”含量,取20.0g样品按下图实验装置与足峨盐酸反应。(已知样品中杂质不溶于水且不与酸反应,装置气密性良好)
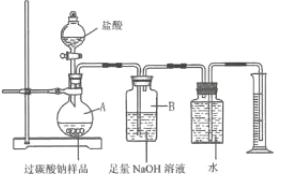
① 将盐酸慢慢滴入A中,反应一段时间,观察到_______,停止滴加盐酸。
② 装置B可吸收生成的CO2,该反应的化学方程式是________________。
③ 甲同学认为若要得出生成氧气的质量,除要记录量筒内液体的读数外,还需要知道的数据是该实验条件下的__________。
④ 将反应后A中所得溶液过滤、蒸发、结晶、烘干,称得固体质量为11.7g,乙同学据此计算出该过碳酸钠样品的“活性氧”含量,写出其计算过程。
⑤ 完成上述探究后,丙同学提出:称量反应前后装置B的质量,其质量差就是反应生成CO2的质量,据此可计算出样品中“活性氧”含量。但丁同学认为该方案不合理,丁同学的理由是_____________________(填写一条即可)。
【答案】(l)碱性;(2)2H2O2 ![]() 2H2O+O2↑。(3)① 无气泡产生。②CO2+2NaOH=Na2CO3+H2O。
2H2O+O2↑。(3)① 无气泡产生。②CO2+2NaOH=Na2CO3+H2O。
③ 氧气密度。④12%。⑤ 盐酸挥发出的HCl进入B中(或生成的CO2没有完全被NaOH溶液吸收)
【解析】【查阅资料】Ⅰ.过碳酸钠在水中易离解成Na2CO3和H2O2,其水溶液具有Na2CO3和H2O2的双重性质;Ⅱ.过碳酸钠能与盐酸反应:2(2Na2CO3·3H2O2)+8HCl=8NaCl+4CO2↑+3O2↑+10H2O;Ⅲ.过碳酸钠的去污能力主要与其在反应中释放出的“活性氧”有关,“活性氧”含量越高,去污能力越强。(1)20℃时,测得1%过碳酸钠水溶液的pH为10.5,PH>7,呈碱性,PH<7,呈酸性。说明其溶液呈碱性。(2)向过碳酸钠水溶液中加入少量MnO2时产生大量气泡,发生反应的化学方程式是2H2O2 ![]() 2H2O+O2↑。(3)过碳酸钠样品中“活性氧”含量。① 将盐酸慢慢滴入A中,反应一段时间,观察到无气泡产生,停止滴加盐酸,此时碳酸钠已反应完。② 装置B可吸收生成的CO2,该反应的化学方程式是CO2+2NaOH=Na2CO3+H2O。③ 甲同学认为若要得出生成氧气的质量,除要记录量筒内液体的读数外,还需要知道的数据是该实验条件下的氧气密度。④ 将反应后A中所得溶液过滤、蒸发、结晶、烘干,称得固体质量为11.7g,乙同学据此计算出该过碳酸钠样品的“活性氧”含量∶2(2Na2CO3·3H2O2)+8HCl=8NaCl+4CO2↑+3O2↑+10H2O;8NaCl→3O2
2H2O+O2↑。(3)过碳酸钠样品中“活性氧”含量。① 将盐酸慢慢滴入A中,反应一段时间,观察到无气泡产生,停止滴加盐酸,此时碳酸钠已反应完。② 装置B可吸收生成的CO2,该反应的化学方程式是CO2+2NaOH=Na2CO3+H2O。③ 甲同学认为若要得出生成氧气的质量,除要记录量筒内液体的读数外,还需要知道的数据是该实验条件下的氧气密度。④ 将反应后A中所得溶液过滤、蒸发、结晶、烘干,称得固体质量为11.7g,乙同学据此计算出该过碳酸钠样品的“活性氧”含量∶2(2Na2CO3·3H2O2)+8HCl=8NaCl+4CO2↑+3O2↑+10H2O;8NaCl→3O2
![]() =
=![]() ,x=2.4g
,x=2.4g
![]() ×100%=12%。
×100%=12%。
⑤ 完成上述探究后,丙同学提出:称量反应前后装置B的质量,其质量差就是反应生成CO2的质量,据此可计算出样品中“活性氧”含量。但丁同学认为该方案不合理,丁同学的理由是盐酸挥发出的HCl进入B中(或生成的CO2没有完全被NaOH溶液吸收).

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案