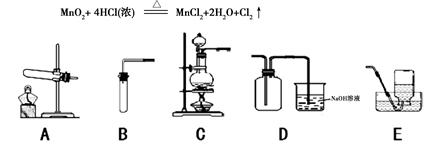
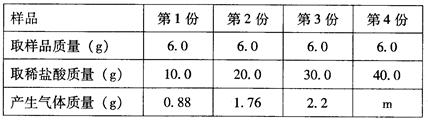
题目内容
一瓶氢氧化钠固体,因不慎敞口放置了一段时间,已经部分变质。化学课外兴趣小组的同学决定测定该瓶试剂变质的程度,他们在知识回顾的基础上,依次进行了如下的实验操作:
《知识回顾》(1)氢氧化钠必须密封保存,理由是:
①氢氧化钠固体会吸收水分而 ;(1分)
②氢氧化钠与二氧化碳反应生成Na2CO3和H2O。
(2)CaCO3不溶于水。
《实验操作》第一步:取该瓶中的试剂20g加水配制成溶液;
第二步:向上述溶液中加入足量的澄清石灰水;
第三步:过滤、干燥、称量,生成沉淀为5g。
《理论计算》(7分)计算该20g试剂中含有杂质Na2CO3的质量分数(写出计算过程)。
《数据分析》(2分)若该瓶试剂中的Na2CO3的质量分数为A,则氢氧化钠的
质量分数 (1-A)(填大于、等于或小于),
原因是 。
《知识回顾》(1)氢氧化钠必须密封保存,理由是:
①氢氧化钠固体会吸收水分而 ;(1分)
②氢氧化钠与二氧化碳反应生成Na2CO3和H2O。
(2)CaCO3不溶于水。
《实验操作》第一步:取该瓶中的试剂20g加水配制成溶液;
第二步:向上述溶液中加入足量的澄清石灰水;
第三步:过滤、干燥、称量,生成沉淀为5g。
《理论计算》(7分)计算该20g试剂中含有杂质Na2CO3的质量分数(写出计算过程)。
《数据分析》(2分)若该瓶试剂中的Na2CO3的质量分数为A,则氢氧化钠的
质量分数 (1-A)(填大于、等于或小于),
原因是 。
《知识回顾》(1)①潮解 (1分)
《理论计算》解:设20g试剂中含Na2CO3质量为x 0.5分
Na2CO3 + Ca(OH)2 ="=" CaCO3↓ + 2NaOH 1分
106 100 1分
X 5g 1分
106/x ="=" 100/5g 1分
X =5.3g 1分
20g试剂中Na2CO3的质量分数为
5.3g/20g ×100﹪ = 26.5﹪ 1分
答:················· 0.5分
《数据分析》小于(1分) 试剂中还含有水分(1分)
《理论计算》解:设20g试剂中含Na2CO3质量为x 0.5分
Na2CO3 + Ca(OH)2 ="=" CaCO3↓ + 2NaOH 1分
106 100 1分
X 5g 1分
106/x ="=" 100/5g 1分
X =5.3g 1分
20g试剂中Na2CO3的质量分数为
5.3g/20g ×100﹪ = 26.5﹪ 1分
答:················· 0.5分
《数据分析》小于(1分) 试剂中还含有水分(1分)
氢氧化钠易吸水而潮解,同时它又能和空气中的二氧化碳反应生成碳酸钠。要求样品中碳酸钠的质量分数,可以通过生成的沉淀碳酸钙5克,求出样品中的碳酸钠的质量。详细过程见答案。因为样品是由碳酸钠、氢氧化钠、水分组成的,所以Na2CO3的质量分数A小于(1-A)

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目