题目内容
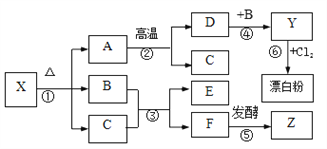
【题目】下图表示某些物质间的转化关系。A是大理石的主要成分,75%的Z溶液是一种常用医用消毒剂,反应③是自然界中最重要的反应,漂白粉的主要成分为氯化钙和次氯酸钙【Ca(ClO)2】,X的化学性质与碳酸氢钠相似。
(1)化学式:X_______ ,Z________;
(2)反应③、⑥的化学方程式:
反应③________,反应⑥___。
(3)反应④为______(选填“放热”或“吸热”)反应。
(4)工业上可用C和NH3合成尿素【CO(NH2)2】和水,反应中C和NH3的质量比为________。
【答案】 Ca(HCO3)2 C2H5OH(C2H6O) 6CO2 + 6H2O![]() C6H12O6 +6O2 2Cl2+2Ca(OH)2===CaCl2+2H2O+Ca(ClO)2 放热 22∶17
C6H12O6 +6O2 2Cl2+2Ca(OH)2===CaCl2+2H2O+Ca(ClO)2 放热 22∶17
【解析】A是大理石的主要成分为CaCO3,75%的Z溶液是一种常用医用消毒剂,可知Z为乙醇,反应③是自然界中最重要的反应,且F发酵生成乙醇,说明反应③为光合作用,由CO2和H2O光合作用下生成淀粉,X的化学性质与碳酸氢钠相似且分解生成碳酸钙、水和CO2,则X为碳酸氢钙;碳酸钙高温下分解生成的D为CaO,CaO和水反应生成的Y为氢氧化钙;
(1)由分析可知,X为Ca(HCO3)2,Z为C2H5OH(C2H6O) ;
(2)反应③为光合作用,反应方程式为 6CO2 + 6H2O![]() C6H12O6 +6O2;反应⑥为石灰乳中通氯气生成氯化钙和次氯酸钙,反应的化学方程式为2Cl2+2Ca(OH)2===CaCl2+2H2O+Ca(ClO)2 ;
C6H12O6 +6O2;反应⑥为石灰乳中通氯气生成氯化钙和次氯酸钙,反应的化学方程式为2Cl2+2Ca(OH)2===CaCl2+2H2O+Ca(ClO)2 ;
(3)反应④为CaO溶解于水,此反应为放热反应;
(4)CO2和NH3合成尿素【CO(NH2)2】和水,反应的化学方程式为CO2+2NH3=CO(NH2)2+H2O,此
反应中CO2和NH3的质量比为(12+16×2)︰[(14+1×1)×2]=22:17。

【题目】某校化学研究性学习课题组的同学们为了测定某氢氧化钙样品中Ca (OH)2含量(含有的杂质为CaCO3),共做了3次实验,使一定质量的该样品分别与同一种盐酸反应,所得相关实验数据记录如下表:
第1次 | 第2次 | 第3次 | |
所取样品的质量 | 20g | 20g | 20g |
所取稀盐酸的质量 | 80g | 100g | 120g |
生成CO2的质量 | 3.58g | 4.4g | 4.4g |
(1)在第 次实验中,反应容器内有白色固体剩余。
(2)求原样品中Ca(OH)2的质量分数?
