题目内容
(1)下表列出了部分人体中含量较多元素的原子结构示意图.请据表回答下列问题:
①属于第二周期的元素是
②K+的核外电子数为
③金属钠、钾的化学性质有许多相似之处,其原因是
④上表中的元素两两化合,能形成AB2型化合物的化学式为
| H | O | Na | Mg | Cl | K | Ca |
 |
 |
 |
 |
 |
 |
 |
O或氧元素
O或氧元素
;Mg2+属于第三
三
周期、第Ⅱ
Ⅱ
族的元素.②K+的核外电子数为
18
18
; 与氧元素形成化合物的化学式为K2O
K2O
.③金属钠、钾的化学性质有许多相似之处,其原因是
原子的最外层电子数相同
原子的最外层电子数相同
.④上表中的元素两两化合,能形成AB2型化合物的化学式为
CaCl2或MgCl2
CaCl2或MgCl2
(写一种).分析:①根据元素周期律:原子的电子层数=周期数,族数值与该原子的最外层电子数相同进行解答;
②根据钾原子最外层电子数是1,易失去电子,可知其核外电子数;并依据化合价书写化学式;
③根据元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似,进行解答;
④根据元素的化合价进行解答.
②根据钾原子最外层电子数是1,易失去电子,可知其核外电子数;并依据化合价书写化学式;
③根据元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似,进行解答;
④根据元素的化合价进行解答.
解答:解:①在元素周期表中,周期数等于它的原子的电子层数,第二周期的元素其原子的电子层数为2,氧元素符合条件;族数值与该原子的最外层电子数相同,镁原子的最外层电子数是2,有三个电子层,故Mg2+属于第三周期,第二族的元素;
故答案为:O或氧元素;三;Ⅱ;
②钾原子有19个电子,最外层电子数是1,易失去1个电子,故K+核外电子数是18;钾元素的化合价是+1价,氧元素的化合价是-2价,所以二者形成化合物的化学式为K2O;
故答案为:18;K2O;
③元素的化学性质和该元素原子的最外层电子数有着密切的关系,一般情况下,两原子的最外层的电子数相同,则该两元素具有相似的化学性质;
故答案为:原子的最外层电子数相同;
④能形成AB2,说明A的化合价数应是B的两倍,故选CaCl2或MgCl2;
故答案为:CaCl2或MgCl2
故答案为:O或氧元素;三;Ⅱ;
②钾原子有19个电子,最外层电子数是1,易失去1个电子,故K+核外电子数是18;钾元素的化合价是+1价,氧元素的化合价是-2价,所以二者形成化合物的化学式为K2O;
故答案为:18;K2O;
③元素的化学性质和该元素原子的最外层电子数有着密切的关系,一般情况下,两原子的最外层的电子数相同,则该两元素具有相似的化学性质;
故答案为:原子的最外层电子数相同;
④能形成AB2,说明A的化合价数应是B的两倍,故选CaCl2或MgCl2;
故答案为:CaCl2或MgCl2
点评:本题主要考查了原子结构示意图及元素周期表的相关知识,能培养学生分析和解决问题的能力.

练习册系列答案
相关题目
(1)下表列出了部分人体中含量较多元素的原子结构示意图.请据表回答下列问题:
| H | O | Na | Mg | Cl | K | Ca |
 |  |  |  |  | 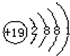 |  |
②K+的核外电子数为________;
③金属钠、钾的化学性质有许多相似之处,其原因是________.
④上表中的元素两两化合,能形成AB2型化合物的化学式为________(写一种).
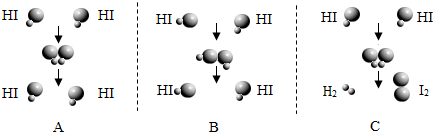
(2)在化学反应中,反应物分子间相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起化学反应.下图表示HI(碘化氢)分子之间的几种碰撞示意图,有些HI分子碰撞后,会发生化学反应产生H2和I2,有些碰撞不会发生反应.图中大球表示碘原子,小球表示氢原子.

①A、B、C三图中,表示HI分子碰撞后发生了化学反应的是________图(选填序号).
②请写出上述所发生反应的化学方程式:________.
③若要得到1个H2分子,至少需要________个HI分子碰撞.
(1)下表列出了部分人体中含量较多元素的原子结构示意图.请据表回答下列问题:
| H | O | Na | Mg | Cl | K | Ca |
 |  |  |  |  |  |  |
②K+的核外电子数为________; 与氧元素形成化合物的化学式为________.
③金属钠、钾的化学性质有许多相似之处,其原因是________.
④上表中的元素两两化合,能形成AB2型化合物的化学式为________(写一种).