题目内容
【题目】碳和碳的化合物是初中化学学习和研究的重要内容。
(1)下列说法不正确的是_____。
A 金刚石和石墨物理性质差异较大的原因是构成的微粒不同
B 碳是形成化合物种类最多的元素
C CO和CO2组成元素相同,化学性质不同的原因是分子构成不同
D 工业上用磁铁矿炼铁的化学方程式为:3CO+Fe2O3![]() 3CO2+2Fe
3CO2+2Fe
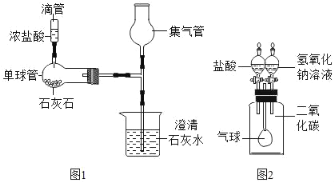
(2)某同学利用如图微型装置进行实验探究。
①写出挤压滴管后单球管中发生的反应的化学方程式_____。
②观察到烧杯中产生了一段时间的气泡,但石灰水不变浑浊的原因是什么?_____。
③将一支湿润的紫色石蕊小花放入集气管中可观察到什么现象?_____。
(3)二氧化碳和氢氧化钠溶液反应没有明显现象。为验证CO2与NaOH能够发生反应,某同学按如图组装实验装置,并进行实验。
①有时药品滴加顺序会影响实验现象。如果观察到的现象是“气球先膨胀,后变瘪”,则加入试剂的顺序应该是什么?_____。
②写出气球“先膨胀”时发生的反应的化学方程式_____。
③请设计方案确定“膨胀后,变瘪前”集气瓶中所得溶液的成分_____。(写出实验步骤、现象、结论)
(4)在科学家眼里,二氧化碳是可以利用的资源。在一定条件下,二氧化碳和金属钠反应可以制得金刚石,同时生成氧化钠。请计算92g金属钠理论上可制得多少含碳96% 的金刚石?_____
【答案】AD CaCO3+2HCl=CaCl2+H2O+CO2↑ 浓盐酸易挥发,是二氧化碳气体中含有氯化氢气气体,不能生成氯化钙沉淀 紫色石蕊小花变红 先加入氢氧化钠溶液,再加入稀盐酸 2NaOH+CO2=Na2CO3+H2O 取加入氢氧化钠溶液后的溶液少许,加入足量的氯化钙溶液,静置,取上层清液滴加酚酞试液若有白色沉淀生成且溶液变红。则溶质为碳酸钠和氢氧化钠,若有白色沉淀生成,溶液不变红,则溶质只有碳酸钠 92g金属钠理论上可制得含碳96%的金刚石的质量为12.5g
【解析】
(1)根据碳的单质、氧化物的结构、性质和用途分析判断有关的说法;
(2)①根据碳酸钙与稀盐酸的反应写出反应的化学方程式;②根据浓盐酸易挥发出氯化氢气体分析回答;③根据二氧化碳与水化合生成了碳酸分析回答。
(3)①根据瓶内压强的变化和物质的性质分析加入试剂的先后顺序;②根据二氧化碳与氢氧化钠的反应写出发生的反应的化学方程式;③根据氢氧化钠和碳酸钠的检验方法分析回答;
(4)根据二氧化碳和金属钠的反应,结合题给的金属钠的质量可以求算出能够制得的金刚石的质量。
(1)A.金刚石和石墨物理性质差异较大的原因是碳原子的排列方式不同,说法错误,故不符合题意;
B.碳是形成化合物种类最多的元素,B说法正确;故符合题意;
C.CO和CO2组成元素相同,化学性质不同的原因是分子构成不同,C说法正确;故不符合题意;
D.磁铁矿的主要成分是四氧化三铁鄙视三氧化三铁,D说法错误;故符合题意;
故选AD
(2)①由微型装置可知,挤压滴管后单球管中发生的反应是碳酸钙与稀盐酸发生了反应,化学方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑。②观察到烧杯中产生了一段时间的气泡,但石灰水不变浑浊的原因是:浓盐酸易挥发,是二氧化碳气体中含有氯化氢气气体,不能生成氯化钙沉淀。③由于二氧化碳能与水化合了碳酸,将一支湿润的紫色石蕊小花放入集气管中可观察到什么现象是紫色石蕊小花变红。
(3)①有时药品滴加顺序会影响实验现象。如果观察到的现象是“气球先膨胀,后变瘪”,瓶内的压强是先变小后变大,由于二氧化碳能与氢氧化钠反应生成了碳酸钠和水,稀盐酸能与碳酸钠反应生成了氯化钠、二氧化碳和水,则加入试剂的顺序应该是先加入氢氧化钠溶液,再加入稀盐酸。
②气球“先膨胀”时发生的反应的是二氧化碳与氢氧化钠反应,化学方程式是:2NaOH+CO2=Na2CO3+H2O。
③由于碳酸钠能与氯化钙反应生成了碳酸钙沉淀和氯化钠,氢氧化钠溶液显碱性,所以设计方案确定“膨胀后,变瘪前”集气瓶中所得溶液的成分是:取加入氢氧化钠溶液后的溶液少许,加入足量的氯化钙溶液,静置,取上层清液滴加酚酞试液若有白色沉淀生成且溶液变红。则溶质为碳酸钠和氢氧化钠,若有白色沉淀生成,溶液不变红,则溶质只有碳酸钠;
(4)设92g金属钠理论上可制得含碳96%的金刚石的质量为x

![]()
![]()
答:92g金属钠理论上可制得含碳96%的金刚石的质量为12.5g。
故填:92g金属钠理论上可制得含碳96%的金刚石的质量为12.5g

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
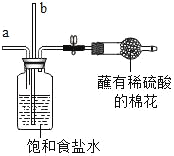
黄冈天天练口算题卡系列答案【题目】“侯氏制碱法”是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺,同学们查阅相关资料并进行模拟实验.
(查阅资料)
①生产原理:NaCl(饱和溶液)+NH3+CO2+H2O=NaHCO3(固体)↓+NH4Cl
②主要生产流程如图所示:
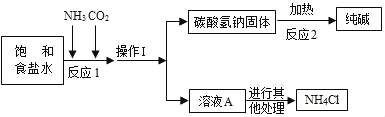
③氨气(NH3)是一种有刺激性气味的气体,极易溶于水,其水溶液显碱性.
(理论分析)
(1)依据资料①可知相同条件下,NaHCO3的溶解度_____NH4Cl的溶解度(填“>”或“<”).
(2)NaHCO3受热分解制得纯碱及两种常见的氧化物,该反应的化学方程式是_____.
(模拟实验)验证侯氏制碱法能获得纯碱
步骤 | 蘸有稀硫酸 实验装置 | 实验操作及现象 | 解释与结论 |
1 |
| 从a管通入NH3,一段时间后,从b管通入CO2,溶液中有固体析出 | (1)蘸有稀硫酸的棉花的作用是_____ (2)通NH3的a管若伸到液面下,会造成的后果是_____ |
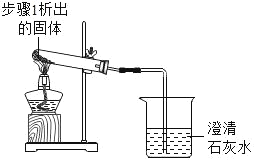
2 |
| 加热,导管口有气泡,澄清石灰水变浑浊 | 步骤1析出的固体是碳酸氢钠 |
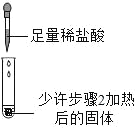
3 |
| 滴加足量稀盐酸,有气泡产生,固体逐渐消失 | 步骤2加热后得到的固体是纯碱 |
(实验反思)同学们认为步骤3的结论存在不足.依据题中信息,设计实验确定步骤2加热后得到的固体成分,其方案是_____.
【题目】宏观和微观相联系是化学独特的思维方式。
(1)①将稀硫酸(甲)逐滴滴入含有酚酞的 NaOH溶液(乙)中,并不断搅拌的原因是___________,说明恰好完全反应(丙)的现象是______________。下图所示是以上反应的微观解释。
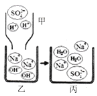
②若要证明使酚酞变化的粒子不是Na+,需选择甲、乙、丙中的__________________。(填“甲”“乙”“丙”)
③已知水能较少量地解离为H+和 OH-且两者数目相等。若稀硫酸过量一滴,请从微观角度解释,溶液显酸性的原因是__________________________。
(2)化学上有一种能将微观粒子数量与宏观物质质量联系起来的量,叫物质的量,其单位是摩尔。1摩尔任何物质中含有构成它的微粒个数都是 6.02×1023个,1摩尔任何物质的质量是以克为单位,数值上都等于该物质的相对分子质量。例如1摩尔水的各种量关系如下:
①1摩尔水分子中氢原子数目是_______个;②1摩尔水中氧元素质量为_______g。
(3)某兴趣小组在相同条件下,将10.00g下列物质分别置于相同规格的烧杯,并敞口存放于空气中,烧杯中物质质量随时间变化如下表,回答下列问题:
时间 | 质量/g | |||||
水 | 饱和石灰水 | 稀盐酸 | 浓硫酸 | 氯化钠浓溶液 | 氯化钙浓溶液 | |
1天 | 8.16 | 8.37 | 8.64 | 11.18 | 9.38 | 10.25 |
2天 | 5.76 | 5.94 | 6.69 | 12.55 | 8.47 | 10.33 |
①下列图示能反映水在空气中放置时发生变化的微观示意图是________________(填字母序号)。(图中 ![]() 表示氧原子,
表示氧原子, ![]() 表示氢原子)
表示氢原子)
A.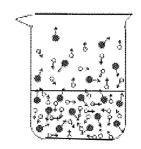
B.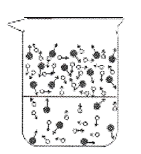
C.
D.
②为研制一种安全、环保的除湿剂,可选择上表中的________________(填溶质的化学式)。