题目内容
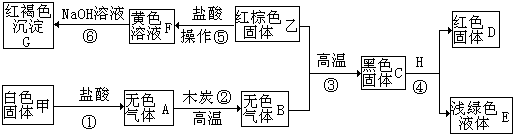
 如图所示是A、B两种固体物质的溶解度曲线.
如图所示是A、B两种固体物质的溶解度曲线.(1)M点的含义是
(2)t1℃时,A、B两种物质的溶解度的大小关系是
(3)t3℃时,把15gA加入25g水中,得到的溶液是
(4)t3℃时,A物质的溶解度为
考点:固体溶解度曲线及其作用,溶质的质量分数、溶解性和溶解度的关系
专题:溶液、浊液与溶解度
分析:(1)根据溶解度曲线交点的意义分析回答;
(2)根据A、B两种固体物质的溶解度曲线,比较在t1℃时,A、B两种物质的溶解度的大小;
(3)根据t3℃时A的溶解度计算分析;
(4)根据t3℃时A的溶解度计算分析.
(2)根据A、B两种固体物质的溶解度曲线,比较在t1℃时,A、B两种物质的溶解度的大小;
(3)根据t3℃时A的溶解度计算分析;
(4)根据t3℃时A的溶解度计算分析.
解答:解:(1)由A、B两种固体物质的溶解度曲线可知,M点是A、B曲线的交点,意义是:t2℃时A、B两物质的溶解度相等;
(2)由A、B两种固体物质的溶解度曲线可知,t1℃时,A、B两种物质的溶解度的大小关系是B>A.
(3)由A的溶解度曲线可知,在t3℃时,A的溶解度是50g,由溶解度的意义可知,25g水中最多溶解12.5g,所以,把15gA加入25g水中,得到的溶液是饱和溶液,溶液的质量是:25g+12.5g=37.5g.
(4)由A的溶解度曲线可知,在t3℃时,A的溶解度是50g,所形成的饱和溶液的质量分数是:
×100%=33.3%.所以,此温度下不能配制40%的A溶液.
故答为(1)t2℃时A、B两物质的溶解度相等;(2)B>A;(3)饱和;37.5g (4)50g;不能.
(2)由A、B两种固体物质的溶解度曲线可知,t1℃时,A、B两种物质的溶解度的大小关系是B>A.
(3)由A的溶解度曲线可知,在t3℃时,A的溶解度是50g,由溶解度的意义可知,25g水中最多溶解12.5g,所以,把15gA加入25g水中,得到的溶液是饱和溶液,溶液的质量是:25g+12.5g=37.5g.
(4)由A的溶解度曲线可知,在t3℃时,A的溶解度是50g,所形成的饱和溶液的质量分数是:
| 50g |
| 100g+50g |
故答为(1)t2℃时A、B两物质的溶解度相等;(2)B>A;(3)饱和;37.5g (4)50g;不能.
点评:本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液的计算,有关的计算要准确,本考点主要出现在选择题和填空题中.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
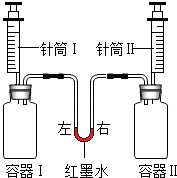 如图所示进行实验,同时将针筒内全部液体迅速注入容器中,实验内容如下表所示.
如图所示进行实验,同时将针筒内全部液体迅速注入容器中,实验内容如下表所示.