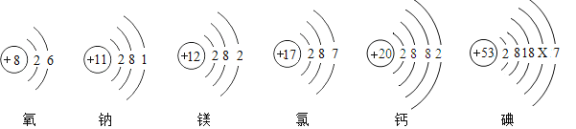
题目内容
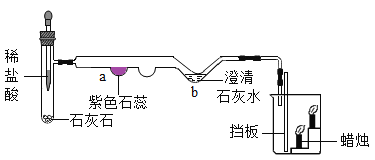
【题目】某实验小组利用如图装置测量空气中氧气体积分数并获得成功,装入药品后连接好仪器,夹紧弹簧夹,将锥形瓶底部放入热水中,白磷很快被引燃,然后将锥形瓶从热水中取出,冷却后打开弹簧夹(注:锥形瓶容积为100mL,注射器内的水为30mL)。下列有关该实验的现象及分析不正确的是( )
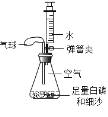
A.气球能缓冲压力防止橡胶塞被冲开
B.该装置可有效防止空气污染
C.细沙可防止锥形瓶的瓶底炸裂
D.注射器内的水全部进入锥形瓶
【答案】D
【解析】
A.气球可用于调节由于温度升高而引起的压强变化,故正确;
B.该装置可有效防止空气污染,故说法正确;
C.红磷燃烧会放出热量,以免炸裂锥形瓶底,需在瓶底铺上细砂,故说法正确;
D.打开弹簧夹后,注射器中的水进入锥形瓶中约占锥形瓶体积的1/5,不是全部,故说法错误;
故选:D。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】某化学兴趣小组在制取二氧化碳实验探究活动中,观察到碳酸钠与稀盐酸的反应速率比大理石与稀盐酸的反应速率快,有同学提出疑问,影响化学反应速率的因素有哪些?化学兴趣小组利用以下试剂对影响化学反应速率的因素开展探究活动。
提供的试剂: 15%的稀硫酸、30%的稀硫酸、铝粉、铁粉、铝片。
(提出问题)影响化学反应速率的因素有哪些?
(猜想与假设)
猜想1:物质的性质; 猜想2:反应的温度;
猜想3:反应物的浓度 猜想4:_____
(实验探究)
实验 | 实验操作 | 实验现象 | 实验结论 |
验证猜想1 | 分别向盛有等体积_____的试管中加入等体积浓度为15%的稀硫酸 | 产生气泡的剧烈程度不同 | 物质的性质影响反应速率 |
验证猜想2 | 分别向盛有等质量铁粉的试管中加入等体积浓度为15%的稀硫酸,并加热其中一支试管 | _____试管中产生气泡剧烈 | 温度越高,反应速率越快 |
验证猜想3 | 分别向盛有等质量铁粉的试管中加入_____ | 产生气泡的剧烈程度不同 | 反应物的浓度越大,反应速率越快 |
验证猜想4 | 如下图所示 | 如下图所示 | _____,反应速率越快 |
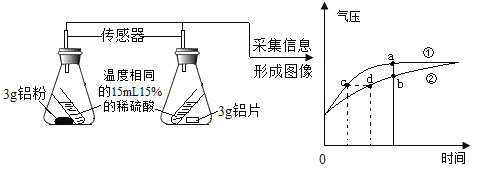
(反思评价)验证猜想4的实验中发生反应的化学方程式为_____。
根据验证猜想4的实验(上图)分析,下列有关说法不正确的是_____(填字母)。
A 对比分析a、b点可知,曲线②表示铝片与稀硫酸反应
B 对比分析c、d点可知,相同的气压时,生成的H2质量相等
C 等质量的铝粉比铝片产生H2的质量多
D a点之后气压几乎不变,表示反应完全
【题目】某班化学兴趣小组对催化剂的问题做了以下两类探究,请你一起参与他们的探究年活动,并填写下列空白:
(1)甲同学探究“催化剂的种类对氯酸钾分解速率的影响”,设计了以下两组对比实验:
I将3.0g氯酸钾和0.5g二氧化锰粉末均匀混合加热;
II将3.0g氯酸钾和Xg氧化铜粉末均匀混合加热;
在相同条件下比较上述两组实验产生氧气的快慢。写出实验I中发生反应的文字表达式________________;实验Ⅱ中X的值应为_____________。
(2)乙同学探究“红砖粉末是否也可以作为氧化氢分解的催化剂”
(提出问题)红砖粉末能不能做氧化氢分解的催化剂呢?
(做出猜想)红砖粉末能做氧化氢分解的催化剂
(实验验证)
实验步骤 | 实验现象 | 实验结论 |
①将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 | 常温下过氧化氢很难分解 |
②在上述试管中加入0.2g红砖粉末,然后将带火星的木条伸入试管中 | 木条复燃 | ________________________ |
③待上述试管反应停止时,重新加入过氧化氢溶液,并把带火星的木条伸入试管 | 红砖粉末的_______没有改变 |
(实验讨论)有同学认为:仅凭上述实验还不能证明红砖粉末能做氧化氢分解的催化剂,还需要增加一个实验“将实验后剩余固体提纯后称量,如果所得固体的质量_____0.2g(选填“大于、小于或者等于”),则说明红砖粉末可以作为氧化氢分解的催化剂”。
(实验拓展)查阅资料得知:硫酸铜、猪肝、土豆等也可以做过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是______________。
A催化剂能增加生成物的量
B酶一种重要的生物催化剂,在工农业生产中起到极大的作用
C催化剂只能加快化学反应的速率
D同一个化学反应可以有多种催化剂