题目内容
【题目】(8分)同学们对实验“煅烧石灰石”展开深入探究。
资料:石灰石中的杂质高温不分解且不与稀盐酸反应
(1)为证明石灰石已分解,三位同学设计方案如下:
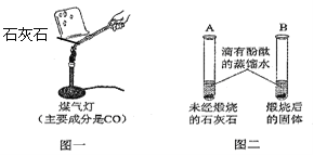
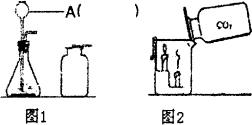
Ⅰ.甲同学按图一所示进行实验(煤气灯亦能达到石灰石分解的温度),观察到烧杯内壁石灰水变浑浊,写出石灰水发生反应的化学方程式 。
II.乙同学按图二所示进行试验,观察到B中液体变 色,A实验的作用 。
III.丙同学取一块质量为12g的石灰石煅烧,一段时间后发现固体质量减轻2.2g,证明石灰石已分解。
IV.大家认为甲同学的方案不合理,请分析原因 。
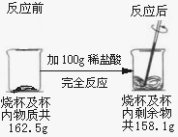
(2)为测定石灰石的纯度,丙同学将他刚才煅烧后的固体放入足量稀盐酸中,又产生2.2g气体,结合上述数据计算:丙所取的这块石灰石中碳酸钙的质量分数是多少?
计算过程写在答卷上
【答案】(1)ⅠCO2+Ca(OH)2=CaCO3↓+H2O Ⅱ 红 对比 ⅣCO燃烧会产生CO2
(2)83.3%
【解析】
试题分析:(1)Ⅰ烧杯内壁石灰水变浑浊,发生的化学方程式为;CO2+Ca(OH)2=CaCO3↓+H2O
Ⅱ石灰石经煅烧后生成氧化钙,氧化钙能与水发生反应:CaO + H2O === Ca(OH)2,Ca(OH)2的水溶液呈碱性,观察到B中液体变红色,A实验的作用:对比
IV因为使用煤气灯加热时,煤气燃烧也会产生CO2
(2)煅烧石灰石,发生的化学反应是:CaCO3![]() CaO+CO2↑,共产生4.4g气体,即二氧化碳的质量,再根据CaCO3和CO2的质量关系,便可算出CaCO3的质量,进而求出石灰石中碳酸钙的质量分数
CaO+CO2↑,共产生4.4g气体,即二氧化碳的质量,再根据CaCO3和CO2的质量关系,便可算出CaCO3的质量,进而求出石灰石中碳酸钙的质量分数
解:设加热分解的碳酸钙的质量为x
CaCO3![]() CaO+CO2↑
CaO+CO2↑
100 44
x 4.4g[来
100:44=x:2.2g
X=10g
石灰石中碳酸钙的质量分数=10g/12g×100%=83.8%

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案【题目】(5分)某实验小组利用废硫酸液制备K2SO4的流程如下:
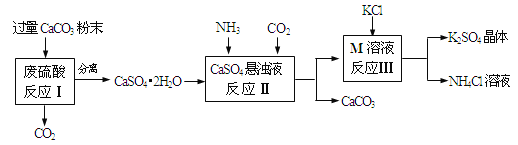
⑴ 将CaCO3研成粉末的目的是 。
⑵ 上述流程中可循环使用的物质有CO2和 (填写化学式)。
⑶ 反应Ⅲ中相关物质的溶解度如下表所示。你认为反应Ⅲ在常温下能实现的原因是
。
物质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
⑷ 为了得到较纯的K2SO4晶体,常用饱和K2SO4溶液洗涤反应Ⅲ所得晶体。为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入 (选填序号,下同),振荡、静置,再向上层清液中滴加 ,观察现象即可判断。
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液
【题目】(5分)在宏观、微观和符号之间建立联系是学习化学的基本方法。
(1)下列为A、B、C、D的原子或离子的结构示意图。
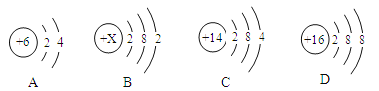
①B的原子结构示意图中X为 ;若D的元素符号为S,则D表示的微粒符号是 。
②分析A、C的原子结构,你认为A与C具有相似化学性质的原因是 。
(2)下图为处理汽车尾气化学反应微观示意图,其中A、B、C、D表示4种物质,A和B在一定条件下反应可生成C 和D。
反应前 | 反应后 |
| ||
|
|
|
| |
③物质C中,各元素的质量比为 。
④根据上述微观示意图,处理汽车尾气的化学反应方程式为 。
【题目】下列相关事实用微观粒子的知识解释错误的是
事 实 | 解 释 | |
A | 湿衣服惊干 | 水分子不断运动 |
B | 蔗糖溶液不导电 | 蔗糖溶液中没有自由移动的带电粒子 |
C | 盐酸、稀硫酸具有相似化学性质 | 都含有相同的氢元素 |
D | 热胀冷缩 | 粒子之间的间隔受热增大,遇冷减小 |