题目内容
 (1)核糖是人类生命活动中不可缺少的一种有机物,它的化学式是C5H10O5,试计算核糖的式量是多少?
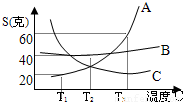
(1)核糖是人类生命活动中不可缺少的一种有机物,它的化学式是C5H10O5,试计算核糖的式量是多少?(2)A、B、C三种物质的溶解度曲线如图,求T1℃时A物质的饱和溶液中溶质的质量分数.
(3)用10克碳酸钙跟足量的稀盐酸反应,可产生二氧化碳气体多少克?
(4)t°C时,26克锌跟200克稀硫酸溶液恰好完全反应,恰好生成饱和溶液.
求:
①生成多少克氢气?
②有多少克纯硫酸参加反应?
③t℃时,生成物的溶解度是多少?.
分析:(1)依据相对分子质量等于各元素相对原子质量之和解答即可;
(2)依据某温度下饱和溶液的溶质质量分数=
×100%解答即可;
(3)根据碳酸钙的质量利用化学方程式的计算即可;
(4)依据锌的质量利用锌与稀硫酸的反应方程式可求生成的氢气质量和反应的硫酸的质量,进而可求出反应后溶液中水的质量(等于硫酸中水的质量),从而可求该温度下硫酸锌的溶解度;
(2)依据某温度下饱和溶液的溶质质量分数=
| 该温度下的溶解度 |
| 该温度下的溶解度+100g |
(3)根据碳酸钙的质量利用化学方程式的计算即可;
(4)依据锌的质量利用锌与稀硫酸的反应方程式可求生成的氢气质量和反应的硫酸的质量,进而可求出反应后溶液中水的质量(等于硫酸中水的质量),从而可求该温度下硫酸锌的溶解度;
解答:解:(1)C5H10O5的相对分子质量=12×5+1×10+16×5=60+10+80=150;
(2)从溶解度曲线图查得:A物质在T1℃时的溶解度为20克g,则t°C时该溶液的溶质质量分数=
×100%=16.7%
(3)设可产生CO2的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
10g x
=
x=4.4g
(4)解:设生成H2的质量为y;参加反应的硫酸的质量为z;生成的硫酸锌的质量为w
Zn+H2SO4═ZnSO4+H2↑
65 98 161 2
26g z w y
=
=
=
y=0.8g z=39.2g w=64.4g
则稀硫酸中含水:200g-39.2g=160.8g,该水也是反应后溶液中溶剂的质量;
t℃时,生成物的溶解度是
×100g=40.1g
答:(1)核糖的相对分子质量为150;
(2)T1℃时,A物质的饱和溶液中溶质的质量分数为16.7%.
(3)用10克碳酸钙跟足量的稀盐酸反应,可产生二氧化碳气体4.4g;
(4)①生成0.8g氢气;②有39.2g纯硫酸参加反应;③t℃时,生成物的溶解度是40.1g;
(2)从溶解度曲线图查得:A物质在T1℃时的溶解度为20克g,则t°C时该溶液的溶质质量分数=
| 20g |
| 100g+20g |
(3)设可产生CO2的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
10g x
| 100 |
| 10g |
| 44 |
| x |
x=4.4g
(4)解:设生成H2的质量为y;参加反应的硫酸的质量为z;生成的硫酸锌的质量为w
Zn+H2SO4═ZnSO4+H2↑
65 98 161 2
26g z w y
| 65 |
| 26g |
| 98 |
| z |
| 161 |
| w |
| 2 |
| y |
y=0.8g z=39.2g w=64.4g
则稀硫酸中含水:200g-39.2g=160.8g,该水也是反应后溶液中溶剂的质量;
t℃时,生成物的溶解度是
| 64.4g |
| 160.8g |
答:(1)核糖的相对分子质量为150;
(2)T1℃时,A物质的饱和溶液中溶质的质量分数为16.7%.
(3)用10克碳酸钙跟足量的稀盐酸反应,可产生二氧化碳气体4.4g;
(4)①生成0.8g氢气;②有39.2g纯硫酸参加反应;③t℃时,生成物的溶解度是40.1g;
点评:该题为化学计算的考查题,重点考查了化学式和方程式的计算,同时涉及到溶解度的相关计算,题型基础考查全面,能巩固初中化学相关基本计算的知识;

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
 (1)核糖是人类生命活动中不可缺少的一种有机物,它的化学式是C5H10O5,试计算核糖的式量是多少?
(1)核糖是人类生命活动中不可缺少的一种有机物,它的化学式是C5H10O5,试计算核糖的式量是多少?