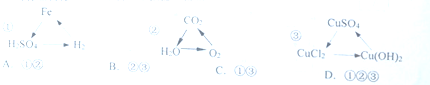
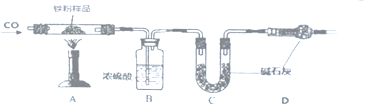
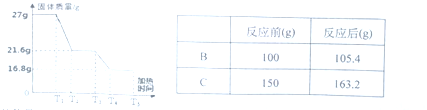
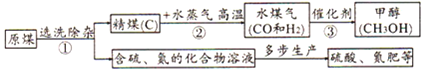
题目内容
【题目】油脂是重要的营养物质。油脂在人体内的化学式为C57H110O6 , 则:
(1)该油脂由种元素组成,其相对分子质量为;
(2)正常人一般每天消耗9 432 kJ的能量,如果能量的25%由油脂提供,那么我们每天大约需要摄入 g油脂,才能维持机体能量平衡。(每克油脂完全氧化能放出39.3 kJ的能量)。
【答案】
(1)3;890
(2)60
【解析】解答:(1)油脂在人体内的化学式为C57H110O6 , 所以该油脂由C、H、O三种元素组成,其相对分子质量为:12×57+1×110+16×6=890。(2)正常人一般每天消耗9 432 kJ的能量,其中25%由油脂提供,所以油脂提供的能量为9 432 kJ×25%,每克油脂完全氧化能放出39.3 kJ的能量,所以需摄入的油脂的质量为: ![]() 分析:本题考查六大营养素中油脂的知识,结合以前的化学式计算,是一道综合性题目,解答时一定要注意各知识点的综合运用。
分析:本题考查六大营养素中油脂的知识,结合以前的化学式计算,是一道综合性题目,解答时一定要注意各知识点的综合运用。

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目