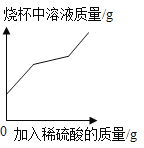
题目内容
【题目】现有一包固体粉末,可能是由CaCO3、Na2CO3、Na2SO4、FeCl3、NaCl、Ba(NO3)2中的一种或几种组成,为确定其成分,进行下列实验(微溶物质按可溶处理)。
步骤一:取少量固体粉末于试管中,加入足量的水溶解,静置后得到白色沉淀A和无色溶液B;
步骤二:过滤,将白色沉淀A放入试管中,滴加过量的稀硝酸,有气泡产生,沉淀部分溶解。过滤得无色溶液C和白色沉淀D;
步骤三:取无色溶液B少许于试管中,滴加过量的稀硝酸,有气泡产生,得到无色溶液E:
步骤四:在溶液E溶液中滴加硝酸银溶液,有白色沉淀产生。
(1)根据步骤一中的现象,可分析出原固体粉末中一定没有的物质是_______:
(2)步骤四中产生沉淀的化学方程式为_________;
(3)白色沉淀A一定含有的物质是_______;
(4)原白色固体中只有一种物质没有确定其是否存在,要确定其是否存在,所补充实验的具体操作是_____。
【答案】FeCl3 ![]() BaSO4、BaCO3 取无色溶液C,滴加适量稀H2SO4,不再产生沉淀后过滤,向滤液加入碳酸钠溶液,观察是否有沉淀
BaSO4、BaCO3 取无色溶液C,滴加适量稀H2SO4,不再产生沉淀后过滤,向滤液加入碳酸钠溶液,观察是否有沉淀
【解析】
碳酸钙难溶于水,氯化铁在溶液中显黄色,碳酸钠和硝酸钡反应生成溶于酸的碳酸钡沉淀,硫酸钠和硝酸钡反应生成不溶于酸的硫酸钡沉淀,氯离子和银离子反应生成氯化银沉淀。
步骤一:取少量固体粉末于试管中,加入足量的水溶解,静置后得到白色沉淀A和无色溶液B,所以样品中一定不含氯化铁,可能含有碳酸钙,可能含有硝酸钡和碳酸钠,硝酸钡和硫酸钠等;
步骤二:过滤,将白色沉淀A放入试管中,滴加过量的稀硝酸,有气泡产生,沉淀部分溶解,过滤得无色溶液C和白色沉定D,所以沉淀中一定会有硫酸钡,碳酸钡和碳酸钙中至少有一种,样品中一定含有硝酸钡和硫酸钠,可能会有碳酸钠或碳酸钙;
步骤三:取无色溶液B少许于试管中,滴加过量的稀硝酸,有气泡产生,得到无色溶液E,所以样品中一定含有碳酸钠;
结合步骤二、三实验现象可知,溶液C中一定存在硝酸钡,可存在硝酸钙,白色沉淀A一定含有的物质是BaSO4、BaCO3,可能存在碳酸钙。
步骤四:在溶液E溶液中滴加硝酸银溶液,有白色沉淀产生,所以样品中一定含有氯化钠。
根据以上分析可知:
(1)根据步骤一中的现象,可分析出原固体粉末中一定没有的物质是FeCl3;
(2)步骤四中产生沉淀的反应是氯化钠和硝酸银反应生成氯化银沉淀和硝酸钠,化学方程式为:![]() ;
;
(3)白色沉淀A一定含有的物质是BaSO4、BaCO3;
(4)溶液C中一定存在硝酸钡,可存在硝酸钙,硝酸钡与稀硫酸反应生成硫酸钡沉淀和硝酸钠,硝酸钙与稀硫酸不能反应(生成硫酸钙微溶,不符合复分解条件),硝酸钙与碳酸钠反应生成碳酸钙沉淀和硝酸钠。原白色固体中只有一种物质碳酸钙,没有确定其是否存在,要确定其是否存在,所补充实验的具体操作是:取无色溶液C,滴加适量的稀硫酸,不再产生沉淀后过滤,向滤液加入碳酸钠溶液,观察是否有沉淀。

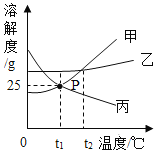
【题目】氯化钠和碳酸钠在不同温度下的溶解度见下表:
温度(℃) | 0 | 10 | 20 | 30 | 40 | |
溶解度(g/100g 水) | 氯化钠 | 35.7 | 35.8 | 36 | 36.3 | 36.6 |
碳酸钠 | 7 | 12.5 | 22 | 40 | 48.8 |
(1)30℃时碳酸钠的溶解度为_____g/100g 水,该温度下碳酸钠饱和溶液的溶质质量分数为_____。
(2)氯化钠的溶解度随温度的升高而_____(选填“增大”或“减小”)。
(3)碳酸钠中混有少量氯化钠,提纯碳酸钠的方法是_____(选填“降温结晶”或“蒸发结晶”)。
(4)区分氯化钠和碳酸钠两种白色固体,可采用以下方法:
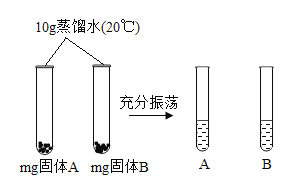
A 是(选填“氯化钠”或“碳酸钠”),m 的取值范围是_____。
Ⅱ.化学方法
查阅资料:氯化钠溶液呈中性,碳酸钠溶液呈碱性。实验药品:蒸馏水,紫色石蕊试液,无色酚酞试液。
实验步骤 | 现象和结论 |
_____ | _____ |
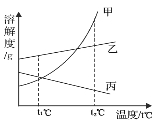
(5)资料显示,碳酸钠溶液的浓度越大,电导率(物质传导电流的能力)越大。用数字化仪器测得溶液中投入无水碳酸钠固体后电导率的变化如下图所示:
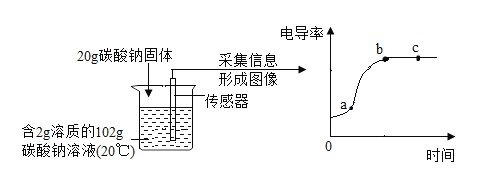
关于 a、b、c 三点所处溶液的分析正确的是_____。
A 溶质质量:a=b=c
B 溶剂质量:a<b=c
C 溶质质量分数:a<b=c
D a、b 是不饱和溶液,c 是饱和溶液