题目内容
【题目】碳酸钙是钙片的主要原料.右图是某钙片说明书上的部分内容.兴趣小组的同学为了测定该钙片说明书上有关碳酸钙含量标注是否属实,进行了如下实验:取出4片片剂,研碎后放入烧杯中,加入过量的稀盐酸,同时测量6分钟(min)内生成CO2质量,测量数据如下表:(假定钙片中其它成分不与盐酸反应)
时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
生成CO2的质量/g | 1.0 | 1.8 | 2.0 | 2.2 | M | 2.2 |
请回答:

(1)上表中M的数值是_____.
(2)根据计算判断该钙片说明书上有关碳酸钙含量标注是否属实_____.
【答案】2.2 属实
【解析】
(1)根据图中数据分析即可解答;
(2)根据反应方程式及生成二氧化碳的质量,计算参与反应碳酸钙的质量,求出该钙片中碳酸钙的质量分数与商标的标注的碳酸钙的含量比较即可。
解:(1)根据图中信息第4分钟和第6分钟产生二氧化碳的质量可知第4分钟时碳酸钙已完全反应,故m=2.2;
(2)设参与反应碳酸钙的质量为x,
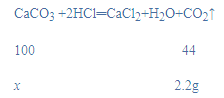
![]()
x=5g,
该钙片中碳酸钙的质量为:![]() =1.25g,
=1.25g,
所以商标的标注的碳酸钙的含量属实。

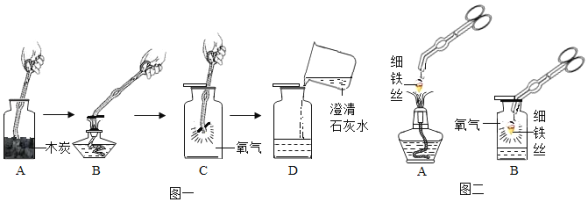
【题目】某课外小组的同学利用老师提供的下列仪器、药品进行实验探究

(1)甲同学设计了两种制取氧气的方案
A 把二氧化锰加入盛有过氧化氢溶液的试管中;
B 把过氧化氢溶液缓缓加入盛有少量二氧化锰的试管中。
能得到平稳氧气流的是_____,(填A或B)
(2)老师提供的红砖粉末有什么作用?乙同学联想二氧化锰作过氧化氢的催化剂,于是想到红砖粉末是否也可以作过氧化氢的催化剂?请你一起参与探究,并回答有关问题
(猜想与假设)红砖粉末能作过氧化氢分解的催化剂。
(实验验证)乙同学设计了如下三个实验:
实验:取一定量过氧化氢溶液于试管中,观察到有极少量气泡产生,将带火星的木条伸入试管中,木条没有复燃。说明过氧化氢在常温下分解缓慢。
实验二:在实验一的试管中加入1克红砖粉末,有大量气泡产生,伸入带火星的木条,木条复燃。说明_____。
实验三:待反应结束后,将试管中的不溶物滤出,并洗涤、于燥、称量,固体的质量仍为1克,说明_____
(实验结论)乙同学认为红砖粉末可以作过氧化氢分解的催化剂。
(反思评价)丙同学认为要证明乙同学的结论正确,还需要再补充一个探究实验这一探究实验的目的是_____。
(拓展)下表是丁同学探究影响过氧化氢分解速率的因素时所记录的数据,通过对数据的分析,你得到的结论是_____。
催化剂及其质量 反应结束所需要的时间/min 过氧化氢溶液的浓度 | 30% | 15% | 5% |
W克二氧化锰 | 0.3 | 0.9 | 2.1 |
W克红砖粉末 | 8.0 | 10.0 | 17.0 |
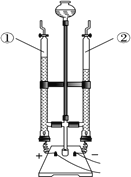
【题目】探究氯酸钾和二氧化锰制氧气实验中反应物与催化剂的最佳质量比.
实验中采用图1实验装置,取20g氯酸钾,分成10等份,每份2g,分别装入10支试管中.在10支试管中分别加入不同质量的二氧化锰,分别测量二氧化锰与氯酸钾在不同质量比时,生成200ml氧气所消耗的时间.实验记录的数据如下:
实验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
二氧化锰的质量(g) | 0.1 | 0.2 | 0.33 | 0.4 | 0.5 | 0.66 | 1 | 1.3 | 2 | 3 |
二氧化锰与氯酸钾的质量比 | 1:20 | 1:10 | 1:6 | 1:5 | 1:4 | 1:3 | 1:2 | 2:3 | 1:1 | 3:2 |
生成200ml氧气时间(秒) | 235 | 186 | 162 | 147 | 133 | 117 | 143 | 160 | 211 | 244 |
请回答下列问题:
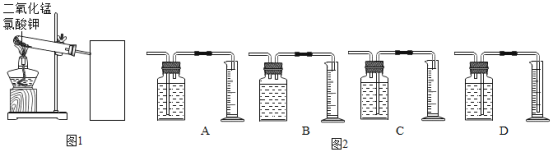
(1)为完成本实验,方框内应选择图2气体收集装置中的是_____(选填序号)该收集利用了氧气的_____性质.收集气体前集气瓶内未装满水,对实验结果_____(填“有”或“没有”)影响.
(2)分析上述数据,你认为利用此法制氧气,二氧化锰与氯酸钾的最佳质量比为_____.
(3)利用双氧水和二氧化锰的混合物制氧气比加热氯酸钾和二氧化锰混合物制氧气更好,请写出前者的两个优点①_____②
(4)催化剂能影响化学反应速度,温度、反应物的浓度、接触面积等也会对化学反应速度带来影响.分析上表数据,结合影响化学反应速度的
①当二氧化锰与氯酸钾的质量比高于最佳质量比时,反应速度变低的原因是_____.
②当二氧化锰与氯酸钾的质量比低于最佳质量比时,反应速度变低的原因是_____.
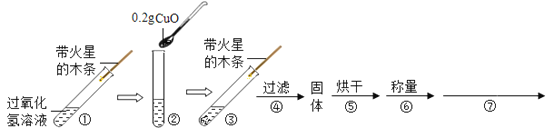
【题目】某校化学兴趣小组的同学在老师的指导下做了有关氧气探究实验:
学习了二氧化锰对过氧化氢分解有催化作用的知识后,某同学想:CuO(氧化铜)能否起类似二氧化锰的催化作用呢?于是进行了以下探究。
(猜想与假设)
Ⅰ.CuO不是过氧化氢分解反应的催化剂
Ⅱ.CuO是过氧化氢分解反应的催化剂。
(实验探究)用天平称量0.2gCuO,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
(1)
步骤③现象 | 步骤⑥结果 | 步骤⑦ | 结论 |
_____ | _____ | _____ | 猜想I不成立; 猜想Ⅱ成立。 |
(2)能证明CuO加快了过氧化氢分解速率的实验步骤是_____;
(3)证明CuO是过氧化氢分解的催化剂,需通过步骤⑦说明_____;
(4)小组同学通过互联网得知,CuSO4溶液也能显著加快过氧化氢的分解,CuSO4溶液主要含有三种粒子(H2O、Cu2+、SO42-),稀硫酸中含有三种粒子(H2O、H+、SO42-),为了进一步探究CuSO4,溶液中哪种粒子能起催化作用,小组同学作了以下分析和设计。
①小组同学认为最不可能的是H2O,他们的理由是_____;
②要说明另外的两种粒子是否起到催化作用小组同学设计了如下实验,完成探究活动。
实验步骤 | 实验现象 | 结论 |
a.取一支试管加入5mL5%过氧化氢溶液,然后加入2-3滴稀硫酸 | 溶液几乎没有气泡放出 | 实验证明,起催化作用的是_____ 。 |
b.另取一支试管加入5mL5%过氧化氢溶液,然后加入2-3滴硫酸铜溶液 | 溶液中有大量气泡放出 |