题目内容
【题目】某化学兴趣小组对用过氧化氢分解生成水和氧气的实验条件进行探究。
【提出问题】哪些因素可能影响该反应的反应速率?
【查阅资料】影响化学反应速率的因素:
①主要因素:反应物本身的性质;
②外界因素:温度,浓度,压强,催化剂,光,激光,反应物颗粒大小,反应物之间的接触面积和反应物状态;
③另外,x射线,γ射线也会影响化学反应速率。
【作出猜想】下面是小组内三位同学所做的猜想,请你完成小丽的猜想。
小红同学:H2O2溶液的浓度可能影响该反应的反应速率。
小明同学:催化剂(MnO2)的用量可能影响该反应的反应速率.
小丽同学:我认为_______________可能影响该反应的反应速率。
【实验验证】
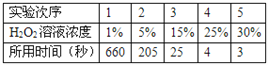
⑴.小红同学的实验是:每次均取10mL30%的H2O2溶液,然后稀释成不同浓度的溶液进行实验,测定各次收集到100mL氧气时所用的时间,记录数据如表:(其他实验条件:温度、催化剂用量等均相同)
请你分析回答:H2O2溶液的浓度对过氧化氢分解制氧气反应速率有什么影响?
__________________
⑵.小明同学的实验是:每次均用30mL10%的H2O2溶液,采用不同量MnO2粉末做催化剂,测定各次收集到500mL氧气时所用的时间,结果如表:(其他实验条件:过氧化氢溶液浓度、温度等均相同)
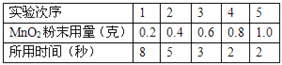
请你分析回答:该反应的化学方程式为_________________;催化剂MnO2的用量对过氧化氢分解制氧气反应速率有什么影响?__________
⑶.如果你是小丽同学,在验证你的猜想时,你的实验方案是:______________________。
【反思与交流】通过该探究实验,你还想探究的问题或还想学习的知识是______________________。
【答案】 温度 在催化剂、温度等相同的条件下,H2O2溶液的浓度越大,反应越快 2H2O2![]() 2H2O+O2↑ 在过氧化氢溶液浓度、温度等相同的条件下,MnO2的用量越大(在一定范围内),反应越快 在MnO2的用量、H2O2溶液的浓度等相同的条件下,控制不同温度,记录收集相同体积的氧气时所用的时间 除MnO2外,是否还有其它物质可作此反应的催化剂(答案合理均可,但应和此题涉及的内容有关)
2H2O+O2↑ 在过氧化氢溶液浓度、温度等相同的条件下,MnO2的用量越大(在一定范围内),反应越快 在MnO2的用量、H2O2溶液的浓度等相同的条件下,控制不同温度,记录收集相同体积的氧气时所用的时间 除MnO2外,是否还有其它物质可作此反应的催化剂(答案合理均可,但应和此题涉及的内容有关)
【解析】[作出猜想]根据与反应有关的外界及内部条件来作出猜想本题中所涉及的就是温度、物质的浓度和质量;[实验验证](1)比较表格中的数据在其他条件都相同时,可以得出过氧化氢的浓度大的收集100ml气体所用时间最短,故本题答案为:在催化剂、温度等相同的条件下,H2O2溶液的浓度越大,反应越快;(2)比较表格中的数据在其他条件都相同时,可以得出二氧化锰的用的质量越大,收集500ml气体所用的时间越短,故本题答案为:2H2O2MnO22H2O+O2↑。在过氧化氢溶液浓度、温度等相同的条件下,MnO2的用量越大(在一定范围内),反应越快;(3)根据本题中能够影响反应速率的因素,作出了温度可能影响反应速率,所以我们可以在过氧化氢浓度相等和二氧化锰用量相等的条件下,来比较在不同的温度下的反应快慢.故本题答案为:在MnO2的用量、H2O2溶液的浓度等相同的条件下,控制不同温度,记录收集相同体积的氧气时所用的时间[反思与交流]
根据题给的条件可以知道,在催化剂改变的时候,对反应的速率是不是有影响,可以选择其他的物质来进行实验进行验证.还想探究的问题:除MnO2外,是否还有其它物质可作此反应的催化剂.