题目内容
酸、碱溶液是化学常见的物质,依据所给内容回答问题:下表是在不同温度下氢氧化钠的溶解度:
| 温度/℃ | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | 31 | 91 | 111 | 129 | 313 | 336 |
(2)在学习过程中,可以判断反应发生的方法有多种.
①向盛有10mL稀盐酸的烧杯中加入氢氧化钠溶液,用pH计(测pH的仪器)测定溶液的pH,所得数据如下:
| 加入NaOH溶液的体积/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | |
| 烧杯中溶液的pH | 1.1 | 1.2 | 1.4 | 1.6 | 2.0 | 7.0 | 11.0 | 12.2 |
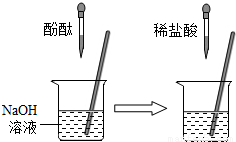
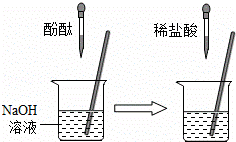
②在如图的实验中,当观察到的现象是 就可证明NaOH与HCl发生了反应.
③不使用指示剂或pH试纸等方法,也可证明反应发生.向稀盐酸和氢氧化钠混合后的溶液中加入一种物质,若没有明显现象出现,说明溶液失去了酸性,从而证明稀盐酸和氢氧化钠已经发生了反应,则该物质是 .
解答:解:(1)氢氧化钠溶液是氢氧化钠溶于水形成的,溶质是氢氧化钠,溶剂是水;20℃时氢氧化钠的溶解度是91g,即100g水中最多溶解91g,20℃时,向100克水中加入100克氢氧化钠固体,所得溶液为饱和溶液,溶液质量为:91g+100g=191g;
(2)①稀盐酸和氢氧化钠溶液恰好完全反应时溶液呈中性,即pH值为7时,所以加入10mL时恰好完全反应;
②盐酸不能使酚酞试液变红,氢氧化钠与盐酸反应后,如果把盐酸反应掉后,再加氢氧化钠溶液显碱性,能使酚酞变红,此时说明氢氧化钠与盐酸发生了反应;
③金属与酸反应产生氢气,碳酸盐与酸反应生成二氧化碳,所以加入活泼金属,或碳酸钙等碳酸盐,如果有气泡产生,说明盐酸过量,如果没有气泡说明盐酸已经完全反应.
故答案为:(1)氢氧化钠;饱和;191;(2)①10;②溶液由红色变为无色;③CaCO3.
点评:解答本题关键是要能够根据物质的溶解度判断溶液是否饱和,溶液的质量计算,知道验证氢氧化钠与盐酸发生反应的方法,会判断盐酸是否过量问题.

 酸、碱溶液是化学常见的物质,依据所给内容回答问题:
酸、碱溶液是化学常见的物质,依据所给内容回答问题:
下表是在不同温度下氢氧化钠的溶解度:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 31 | 91 | 111 | 129 | 313 | 336 |
(2)在学习过程中,可以判断反应发生的方法有多种.
①向盛有10mL稀盐酸的烧杯中加入氢氧化钠溶液,用pH计(测pH的仪器)测定溶液的pH,所得数据如下:
| 加入NaOH溶液的体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 |
| 烧杯中溶液的pH | 1.1 | 1.2 | 1.4 | 1.6 | 2.0 | 7.0 | 11.0 | 12.2 |
②在如图的实验中,当观察到的现象是______ 就可证明NaOH与HCl发生了反应.
③不使用指示剂或pH试纸等方法,也可证明反应发生.向稀盐酸和氢氧化钠混合后的溶液中加入一种物质,若没有明显现象出现,说明溶液失去了酸性,从而证明稀盐酸和氢氧化钠已经发生了反应,则该物质是______.
酸、碱溶液是化学常见的物质,依据所给内容回答问题:
下表是在不 同温度下氢氧化钠的溶解度:
同温度下氢氧化钠的溶解度:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 31 | 91 | 111 | 129 | 313 | 336 |
(1)氢氧化钠溶液中的溶质是 。20℃时,向100克水中加入100克氢氧化钠固体,所得溶液为 溶液(填“饱和”或“不 饱和”),其溶液的质量是 克。
饱和”),其溶液的质量是 克。
(2)在学习过程中,可以判断反应发 生的方法有多种。
生的方法有多种。
①向盛有10mL稀盐酸的烧杯中加入氢氧化钠溶液,用pH计(测pH的仪器)测定溶液的pH,所得数据如下:
| 加入NaOH溶液的体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 |
| 烧杯中溶液的pH | 1.1 | 1.2 | 1.4 | 1.6 | 2.0 | 7.0 | 11.0 | 12.2 |
当加入氢氧化钠溶液的体积为 mL时,稀盐酸和氢氧化钠溶液恰好完全反应。
②在右图的实验中,当观察到的现象是
就可证明NaOH与HCl发生了反应。
③不使用指示剂或pH试纸等方法,也可证明反应发生。向稀盐酸和氢氧化钠混合后的溶液中加入一种物质,若没有明显现象出现,说明溶液失去了酸性,从而证明稀盐酸和氢氧化钠已经发生了反应,则该物质是 。
酸、碱溶液是化学常见的物质,依据所给内容回答问题:
下表是在不同温度下氢氧化钠的溶解度:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 31 | 91 | 111 | 129 | 313 | 336 |
(1)氢氧化钠溶液中的溶质是 .20℃时,向100克水中加入100克氢氧化钠固体,所得溶液为 溶液(填“饱和”或“不饱和”),其溶液的质量是 克.
(2)在学习过程中,可以判断反应发生的方法有多种.
①向盛有10mL稀盐酸的烧杯中加入氢氧化钠溶液,用pH计(测pH的仪器)测定溶液的pH,所得数据如下:
| 加入NaOH溶液的体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 |
| 烧杯中溶液的pH | 1.1 | 1.2 | 1.4 | 1.6 | 2.0 | 7.0 | 11.0 | 12.2 |
当加入氢氧化钠溶液的体积为 mL时,稀盐酸和氢氧化钠溶液恰好完全反应.
②在如图的实验中,当观察到的现象是 就可证明NaOH与HCl发生了反应.
③不使用指示剂或pH试纸等方法,也可证明反应发生.向稀盐酸和氢氧化钠混合后的溶液中加入一种物质,若没有明显现象出现,说明溶液失去了酸性,从而证明稀盐酸和氢氧化钠已经发生了反应,则该物质是 .
 (2013?怀柔区一模)酸、碱溶液是化学常见的物质,依据所给内容回答问题:
(2013?怀柔区一模)酸、碱溶液是化学常见的物质,依据所给内容回答问题: