题目内容
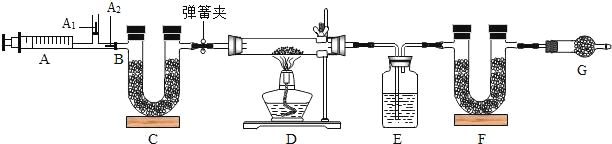
【题目】在实验室中,同学们用如图装置制取纯净干燥的CO2。
(查阅资料)饱和碳酸氢钠溶液可以吸收HCl而不吸收CO2
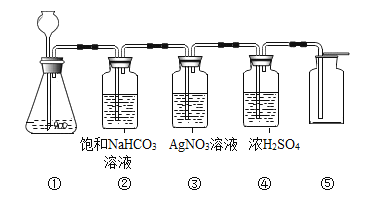
(1)实验室用石灰石和稀盐酸制取二氧化碳,该二氧化碳气体含有的杂质是氯化氢气体和__________(填物质名称)。
(2)若缺少装置②,则装置③中可能会出现白色浑浊,其原因是__________(用化学方程式表示)。
(3)若将装置④做在装置③前面,产生的后果是__________。
(4)在装置⑤中是用瓶口朝上方法收集二氧化碳气体,其原因是_______。
【答案】水蒸气 AgNO3+HCl=AgCl↓+HNO3 收集的二氧化碳不干燥(合理即可) 二氧化碳的密度比空气的密度大
【解析】
(1)实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热,该反应制取的二氧化碳气体含有氯化氢气体和水蒸气两种杂质;
(2)若缺少装置②,则装置③中可能会出现白色浑浊,因为氯化氢气体没有被除去,氯化氢和硝酸银反应生成氯化银白色沉淀和硝酸,化学方程式为:HCl+AgNO3=AgCl↓+HNO3;
(3)将装置④做在装置③前面,产生的后果是收集的二氧化碳不干燥;
(4)二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集。

练习册系列答案
相关题目
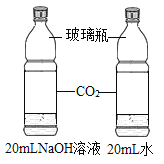
【题目】设计对比实验,控制变量是学习化学的重要方法,下列对比实验不能达到实验目的的是
编号 | A | B | C | D |
实验设计 |
|
|
|
|
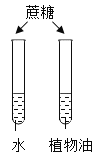
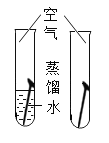
实验目的 | 探究同种物质在不同溶剂中的溶解性 | 探究物质燃烧的条件 | 探究铁生锈的条件 | 探究CO2与NaOH溶液能否发生反应 |
A.AB.BC.CD.D