题目内容
【题目】
(1)探究学习小组在实验室中用下图所示装置制取 CO2 并探究 CO2与过氧化钠(Na2O2)的反应。
【查阅资料】过氧化钠(Na2O2)是一种淡黄色固体,能与 CO2、H2O 发生反应: 2Na2O2+2CO2=2Na2CO3+O2 , 2Na2O2+2H2O=4NaOH+O2↑。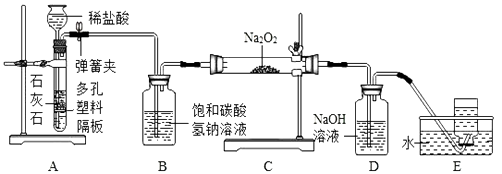
请回答下列问题:
①装置 A 中发生反应的化学方程式为 , 利用装置 A 制取 CO2 的优点是;
②装置B的作用为 ;
③装置D中发生反应的化学方程式为;
④装置E中中收集的气体该还可用下图装置中 (填字母序号)
收集。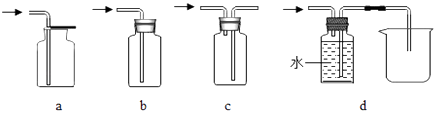
⑤为探究反应后装置 C 硬质玻璃管中固体的成分,该小组同学进行了如图实验: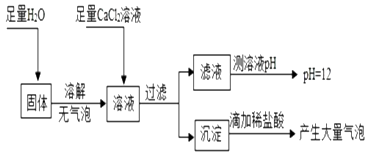
根据判断,反应后装置C硬质玻璃管中固体为。
(2)冬季取暖人们常用到暖宝宝,小明同学对它很好奇,于是找来一袋暖宝宝(如下图),进行了以下探究:
①通过查阅资料他知道了暖宝宝的热量来源于铁的缓慢氧化,发热原理是铁粉与氧气、水共同作用生成氢氧化铁,该反应的化学方程式为。
②小明同学利用暖宝宝测定空气中氧气的含量,设计了图1所示装置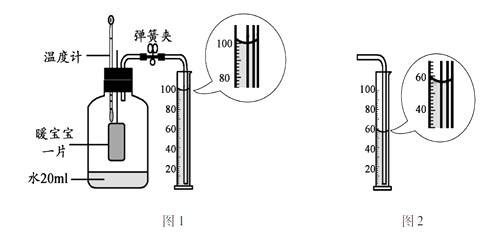
(3)【实验步骤】a.检查装置气密性 b.向250mL集气瓶中加入20mL水c.读取温度计示数为18oC,撕掉暖宝宝上的贴纸,塞紧橡胶塞d.观察温度计示数的变化e. 待温度计示数为18oC时,打开止水夹
【实验结论】小明同学的实验结果如图2所示,根据图示数据计算出空气中氧气的体积分数为。
(4)【实验反思】你认为小明同学实验产生误差的可能原因有(写出一条即可)。
(5)【拓展探究】 小明同学认为使用后的暖宝宝中还一定含有食盐,于是继续进行以下实验,请你帮他完成下面表格:
实验内容 | 实验现象 | 实验结论 |
使用后的暖宝宝中还有食盐 |
【答案】
(1)CaCO3+2HCl═CaCl2+H2O+CO2↑;便于控制反应的发生和停止;吸收二氧化碳中的HCl气体;2NaOH+CO2=Na2CO3+H2O;a d;氢氧化钠和碳酸钠
(2)4Fe+6H2O+3O2=4Fe(OH)3
(3)19.1%
(4)暖贴内铁粉的量不够,O2没有完全被消耗
(5)取使用后的样品少量于烧杯中,加入足量的水溶解、过滤,向滤液中滴加硝酸银溶液;生成白色沉淀
【解析】(1)①反应的化学为:CaCO3+2HCl═CaCl2+H2O+CO2↑;装置A的优点是能使反应随时进行或停止;
②装置B的作用是吸收二氧化碳中的氯化氢气体;
③生反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O;
④用a、d装置收集氧气
⑤装置C硬质玻璃管中固体为碳酸钠和氢氧化钠。
(2)反应的化学方程式是:4Fe+3O2+6H2O═4Fe(OH)3;
②【实验结论】氧气的体积分数为:![]() ,即氧气约占空气体积的1/5;
,即氧气约占空气体积的1/5;
实验反思:产生误差的可能原因有装置漏气,会使进入的水偏少,测定的结果偏小;暖贴内铁粉的量不够,O2没有完全被消耗;
【拓展探究】
实验内容 | 实验现象 | 实验结论 |
取使用后的样品少量于烧杯中,加入足量的水溶解、过滤,向滤液中滴加硝酸银溶液 | 生成白色沉淀 | 使用后的暖宝宝中还有食盐 |
(1)①装置A中石灰石中的碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,,发生反应的化学为:CaCO3+2HCl═CaCl2+H2O+CO2↑;利用装置A制取CO2的优点是能使反应随时进行或停止;
②碳酸氢钠能和稀盐酸反应生成氯化钠、水和二氧化碳,因此装置B的作用是吸收二氧化碳中的氯化氢气体;
③装置D中氢氧化钠和二氧化碳反应生成碳酸钠和水,发生反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O;
④装置E中收集的气体是氧气,氧气密度比空气大,可以用向上排空气法收集,即用a装置收集,氧气不易溶于水,可以用排水法收集,即用d装置收集;所以可以采用用a、d装置收集氧气;
⑤加入足量水,不产生气泡,说明固体中不含有过氧化钠,加入足量氯化钙溶液后溶液显碱性,说明固体中含有氢氧化钠,沉淀能和稀盐酸反应生成气体,说明沉淀是碳酸钙,进一步说明固体中含有碳酸钠,因此反应后装置C硬质玻璃管中固体为碳酸钠和氢氧化钠。
(2)①暖宝宝中含有铁粉、活性炭、水、氯化钠等物质,遇空气发生反应的化学方程式是:4Fe+3O2+6H2O═4Fe(OH)3;
②【实验结论】根据反应前后烧杯内水的体积变化可以看出,消耗的氧气的体积是:100mL56mL=44mL,故氧气的体积分数为: 44 m L 250 m L 20 m L × 100 % ≈ 19.1 % ,即氧气约占空气体积的1/5;
实验反思:反思实验过程,你认为小组同学实验产生误差的可能原因有装置漏气,会使进入的水偏少,测定的结果偏小;暖贴内铁粉的量不够,O2没有完全被消耗;
【拓展探究】因为要要测定是氯化钠的质量,可以使其与硝酸银反应,根据是否删除变色沉淀来判断

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案