题目内容
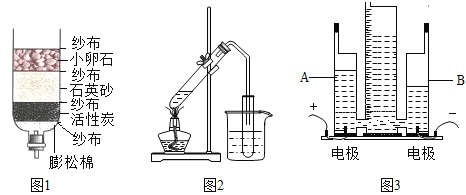
【题目】按如图组装仪器,关闭止水夹,通电使红磷燃烧。请回答下列问题:
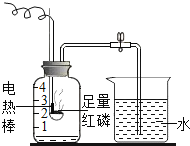
(1)红磷燃烧的现象是______;
(2)红磷燃烧一段时间后,自动熄灭了,你认为原因是______;
(3)冷却后,松开止水夹,你观察到的现象为_____,由此得出的有关空气组成结论是______;
(4)实验完毕,若进入集气瓶中水的体积偏低,你认为导致这一结果的原因可能是_______(只答一条);
(5)该实验装置改进后与书上的实验相比,它的优点是______(只答一条).
【答案】红磷剧烈燃烧,产生大量白烟,放出大量热 氧气不足 烧杯中的水沿着导管进入集气瓶中,最终水约占集气瓶体积的五分之一 空气中氧气的体积分数约为五分之一 装置漏气或者导管中原先没有充满水 减少手工点燃红磷,关闭活塞环节带来的误差
【解析】
(1)红磷燃烧产生五氧化二磷颗粒,现象是红磷剧烈燃烧,产生大量白烟,放出大量热;
(2)燃烧需要可燃物与氧气充分接触,红磷燃烧一段时间后,自动熄灭了,原因是大部分氧气已经反应掉,容器内氧气不足;
(3)冷却后,松开止水夹,由于氧气约占空气体积的五分之一,反应后装置内气体减少,压强变小,小于大气压,观察到的现象为烧杯中的水沿着导管进入集气瓶中,最终水约占集气瓶体积的五分之一,由此得出的有关空气组成结论是空气中氧气的体积分数约为五分之一;
(4)测定空气中氧气含量的原理是,利用物质与空气中的氧气反应,又不生成气体,使瓶内气体减少,压强变小,水倒流入集气瓶内,倒流的水的体积就等于瓶内氧气的体积。结果偏小的原因是: 红磷量不足或装置漏气或装置未冷却至室温就打开弹簧夹等;
(5)该实验装置改进后与书上的实验相比,它的优点是操作简单,装置始终密闭,能保持良好的气密性,使测定结果更准确。

【题目】某兴趣小组同学对实验室制取氧气的催化剂进行如下探究:
(提出问题)二氧化锰常作为氯酸钾分解制取氧气的催化剂,其他氧化物是否也能催化氯酸钾分解呢?
(查阅资料)研究表明,许多金属氧化物对氯酸钾的分解(分解时放出热量)有催化作用。分别用下列金属氧化物作催化剂,氯酸钾开始发生分解反应和反应剧烈时的温度如表所示:
氧化铁 | 氧化铝 | 氧化铜 | 氧化镁 | |
开始反应(℃) | 420 | 515 | 305 | 490 |
剧烈反应(℃) | 490 | 540 | 350 | 545 |
(1)实验室用氯酸钾制取氧气,如果不用二氧化锰作催化剂,最好选用的金属氧化物是_____。
(设计并完成实验)Ⅰ.将3.0g氯酸钾放在试管中加热
Ⅱ.将3.0g氯酸钾与1.0g二氧化锰混合均匀加热
Ⅲ.将Xg氯酸钾与1.0g氧化铜混合均匀加热
(2)实验Ⅲ中X的值应为_____,实验_____和Ⅲ比较可证明氧化铜能加快氯酸钾的分解速率。
(实验现象分析)将实验Ⅲ反应后的固体加水溶液、过滤、洗涤、干燥,若称量得到1.0g黑色粉末,再将黑色粉末和Xg氯酸钾混合加热,现象与实验Ⅲ相同。
(3)在相同温度下比较两组实验产生氧气的快慢,通常可采用的方法有_____。
(结论)氧化铜也能做氯酸钾分解的催化剂。
(4)实验Ⅲ反应的文字表达式为_____。
注意:若答对第(5)小题奖励4分,化学试卷总分不超过60分。
(5)氯酸钾分解制取氧气的快慢还与哪些因素有关?请你提出新的合理的假设和实验方案。
(假设)_____。
(实验方案)_____。
(结论)_____。