��Ŀ����
����Ŀ���ں�ۡ��ۺͷ���֮�佨����ϵ�ǻ�ѧѧ�Ƶ��ص㡣�밴Ҫ����ա�
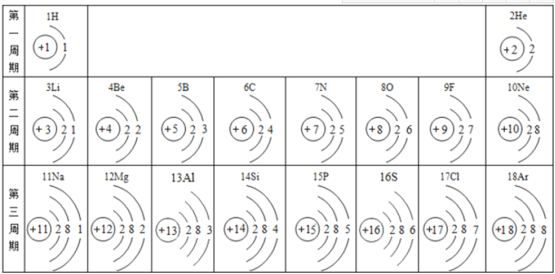
��1���û�ѧ�����ʾ��
��3����������___________��
�ڹ����Ȼ��Ƶ�����___________��
������þ��þԪ�صĻ��ϼ�Ϊ+2��___________��
�ܷ����������⣨H2O2���������ƣ�Na2O2������Ԫ�صĻ��ϼۣ�д���������ƵĻ�ѧʽΪ___________��
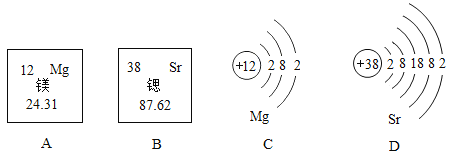
��2����ͼ���������ӵĽṹʾ��ͼ����ش��������⣺

���Ӣ��ڻ�ѧ��Ӧ����__________(�����õ�������ʧȥ��)���ӣ����Ӣܱ�ʾ��Ԫ����Ԫ�����ڱ���λ�ڵ�___________���ڡ������Ӣ۴���3����λ������ɣ�������ӿɱ�ʾΪ___________�����������У�����ϡ������Ԫ�ص�������________(�����)��
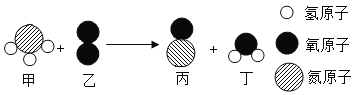
��3���ڸ��������£�A��B�������ʿ��Է�����ѧ��Ӧ����C��D����Ӧǰ���������仯����ʾ��ͼ��ͼ��ʾ��
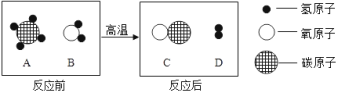
�����������У��������������__________����ͼ�е���ĸ����
���ڸ÷�Ӧ�У�����C��D��������Ϊ___________��
���𰸡�3Fe2+ Na+��Cl- ![]() CaO2 �õ� �� Al3+ �� BC 14:3
CaO2 �õ� �� Al3+ �� BC 14:3
��������
��1���������ӵı�ʾ�������ڱ�ʾ�����ӵ�Ԫ�ط������Ͻǣ���������������������������������ǰ�����������ں�1�����ʱ��1Ҫʡ�ԡ���ʾ��������ӣ����������ӷ���ǰ������Ӧ�����֣�3���������ӿɱ�ʾΪ3Fe2+���ڹ����Ȼ��Ƶ�������Na+��Cl-���ۻ��ϼ۱���Ԫ�ط��ŵ����Ϸ�������þ��þԪ�صĻ��ϼ�Ϊ+2�ۣ��ɱ�ʾΪ��![]() ���ܸ��ݹ������⣨H2O2���������ƣ�Na2O2���Ļ�ѧʽ��֪��������������Ԫ�صĻ��ϼ�Ӧ��Ϊ-1�����ݻ������и�Ԫ�ػ��ϼ۵Ĵ�����Ϊ�㣬�������ƵĻ�ѧʽΪ��CaO2��
���ܸ��ݹ������⣨H2O2���������ƣ�Na2O2���Ļ�ѧʽ��֪��������������Ԫ�صĻ��ϼ�Ӧ��Ϊ-1�����ݻ������и�Ԫ�ػ��ϼ۵Ĵ�����Ϊ�㣬�������ƵĻ�ѧʽΪ��CaO2��
��2�����Ӣ��������7�����ӣ��ڻ�ѧ��Ӧ���õ����ӣ����Ӣܺ�����11�����ӣ����ԭ�Ӻ�����3�����Ӳ㣬�ʸ�Ԫ����Ԫ�����ڱ���λ�ڵ�3���ڡ������Ӣ۴���3����λ������ɣ���������������ӣ��ɱ�ʾΪAl3+�����������У�����ϡ������Ԫ�ص������Ǣݣ����������ԭ�ӡ�
��3��������������Ԫ������һ��Ԫ����ɵĻ���������Ͽ������������������ԭ�Ӻ���һ��ԭ�ӹ��ɵģ������������У��������������BC�����ɷ�Ӧ����ʾ��ͼ��֪���÷�Ӧ�ǣ�CH4+H2O![]() CO+3H2���ڸ÷�Ӧ�У�����C��D��������Ϊ��28����3��2��=14:3��
CO+3H2���ڸ÷�Ӧ�У�����C��D��������Ϊ��28����3��2��=14:3��

 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�