题目内容
【题目】为测定空气中氧气体积分数,设计如图实验。
(1)该实验中红磷需要过量的原因是________;
(2)红磷燃烧反应的文字表达式为________________;
(3)冷却至室温后打开止水夹观察到的现象是________;
(4)实验过程中,进入广口瓶内水的体积小于广口瓶内气体容积的1/5,试分析可能原因:__________________。
【答案】将集气瓶内空气中的氧气全部消耗掉 红磷+氧气![]() 五氧化二磷 烧杯中的水进入集气瓶,集气瓶中液面上升至刻度线1处 红磷的量不足;装置漏气;没有恢复到室温就打开止水夹等
五氧化二磷 烧杯中的水进入集气瓶,集气瓶中液面上升至刻度线1处 红磷的量不足;装置漏气;没有恢复到室温就打开止水夹等
【解析】
(1)该实验中红磷需要过量的原因是将集气瓶内空气中的氧气全部消耗掉;
(2)红磷在空气中燃烧生成五氧化二磷,文字表达式为:红磷+氧气![]() 五氧化二磷;
五氧化二磷;
(3)红磷燃烧消耗了氧气,瓶内的压强减小,冷却至室温后打开止水夹,观察到的现象是:烧杯中的水进入集气瓶,集气瓶中液面上升至刻度线1处;
(4)如果所用红磷的量不足,造成瓶内空气中的氧气没有完全被消耗,会使所测得的氧气的体积分数偏小;如果装置漏气,则形成的压强差会从漏气的地方进入空气,也会导致进入集气瓶的水的量偏小,即测得氧气的体积分数偏小;如果没有恢复到室温就打开止水夹,集气瓶中气体处于膨胀状态,也会导致进入集气瓶的水的量偏小,即测得氧气的体积分数偏小;故答案为:红磷的量不足;装置漏气;没有恢复到室温就打开止水夹等。

【题目】空气中氧气含量测定的再认识。某化学兴趣小组的同学,在实验室用红磷、镁条、木炭等物质代替汞对空气中氧气的含量测定进行模拟探究。
(实验一) A组同学通过燃烧红磷法测定空气中氧气的含量,装置如(图一)所示,写出红磷燃烧的符号表达式:____________________________________。
实验过程如下:
(1)用弹簧夹夹紧橡皮管;
(2)点燃燃烧匙内的红磷,观察到红磷燃烧,立即伸入瓶中并塞紧瓶塞;
(3)等装置冷却至室温后,打开弹簧夹;
(4)观察并记录水面的变化情况发现,集气瓶内上升的水面小于瓶内原有空气体积的五分之一,可能的一个原因是:____________________________________。
(实验二) B组同学利用镁条在空气中燃烧测定空气中氧气含量,如(图二)所示,实验结束后,待装置冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶容积的70%。根据空气的组成推测可能的原因是____________________________________。
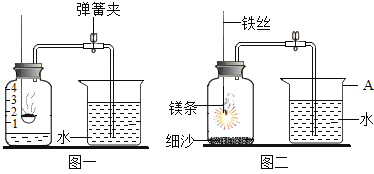
(实验三) C组”利用木炭燃烧测定空气中氧气的体积分数”,根据经验,利用上图装置测定空气中氧气含量时,能否用木炭替代?___________(填“能”或“不能”)原因是:______________________。
(提供资料)氢氧化钠能与二氧化碳反应生成碳酸钠和水
该小组同学选择用氢氧化钠溶液吸收生成的二氧化碳气体(如图三),但进入集气瓶中水的体积分数仍然小于1/5 。

(提出问题)是什么原因导致测量不准确呢?
(猜想与假设)他们分别作了如下猜想:
甲同学:可能是木炭取的量过少;
乙同学:可能是木炭燃烧没有消耗完集气瓶中的氧气;
丙同学:可能是木炭与空气反应生成了其他气体。
(查阅资料)
资料一:木炭、棉花和蜡烛在密闭容器内燃烧停止后,残留氧气的体积分数分别高达14.0%,8.0%和16.0%。
资料二:木炭在密闭容器中不充分燃烧会生成一氧化碳气体。
资料三:一氧化碳能与灼热的氧化铜粉末(黑色)反应生成铜(红色)和二氧化碳气体
(探究一)
小组同学发现实验结束后,燃烧匙中还有残留的黑色固体,可知__________同学的猜想不合理。
(探究二)乙同学又利用上述装置设计了如下实验,请你填写下表:
实验步骤 | 实验现象 | 实验结论 |
① 将足量木炭点燃,迅速插入装有氧气的 集气瓶中 | ______________ | 木炭燃烧没有 消耗完集气瓶 中的氧气 |
② 待装置冷却后,将燃着的___________ (填“棉花”或“蜡烛“)再伸入集气瓶中 | _______________ |
(探究三)
小明从木炭燃烧产物的角度猜想还可能是生成了_________________导致测量结果小于1/5;于是用注射器抽取集气瓶内的气体做了上图(图四)所示的实验,当观察到d中________________________(填实验现象),可证明小明的猜想成立。
(经典对比)通过与上述实验对比,拉瓦锡选择用汞的优点有_________________
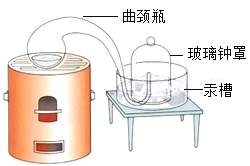
A 能将密闭装置内空气中的氧气几乎耗尽
B 在汞槽中起到液封作用
C 实验过程中没有污染
D 生成的化合物加热分解又能得到汞和氧气
【题目】我们每时每刻都生活在空气的“海洋”里。
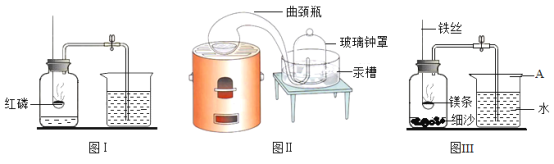 ..
..
一、空气及其成分探究
(1)图Ⅰ用于粗略研究空气的组成,发生反应的文字或符号表达式为___________________。
(2)拉瓦锡用图Ⅱ所示装置研究了空气的组成。他把少量汞放在密闭的容器中连续加热,得到了红色氧化汞粉末,同时钟罩内的汞液面上升。该反应的文字或符号表达式是:____________。
(3)某学习小组用图Ⅲ装置进行镁条在空气中燃烧的实验。燃烧、冷却后打开止水夹,有水进入了集气瓶 。
(问题)实验操作正确,但实验后发现进入集气瓶中水的体积约为其容积的 70%。
(猜想)镁除了与氧气反应外,还与空气中的其他气体(X)发生了反应。对该气体提出猜想:
猜想1:只是二氧化碳 猜想2:只是氮气 猜想3:氮气和二氧化碳等
(资料)镁是一种化学性质活泼的金属,能在氮气燃烧生成氮化镁,能在二氧化碳中燃烧生成碳和氧化镁。
①经讨论一致认为猜想1不正确,理由是___________;
②镁在二氧化碳中燃烧的文字或符号表达式_______________。
(结论)猜想3正确
(4)(改进实验)小明同学利用如图装置测定空气中氧气含量,步骤如下(装置气密性良好,部分操作已略去,因导管产生的误差忽略不计):

Ⅰ.打开止水夹a、b,向集气瓶中通入一定量的空气,使盛有白磷的燃烧匙在水面上方,测得进入量筒中水的体积为V1。
Ⅱ.关闭止水夹a,用强光照射引燃白磷。白磷熄灭并冷却至室温,至液面不再变化,测得量筒内水的体积是V2。 根据实验记录V1、V2,得出空气中氧气的体积分数的计算式是_______________。
二、氧气的制备和性质
实验一:用高锰酸钾制取一瓶氧气,做细铁丝燃烧实验。

(5)铁丝在氧气中燃烧的文字或符号表达式___________。
(6)用B收集到的氧气做细铁丝燃烧的实验时,发现瓶壁炸裂,分析原因:___________。
(7)小组同学改进了实验一(如图E),优点是__________。
A氧气无需提前制备和收集,操作更方便。
B塑料瓶代替集气瓶,防止集气瓶炸裂,更安全。
C装置集氧气的制取、干燥、性质于一体,实验更优化。
(8)潜水艇要配备氧气的再生装置,以保证长时间潜航。有以下几种制氧气的方法:
①加热高锰酸钾;
②双氧水催化分解;
③常温下用过氧化钠固体与二氧化碳反应生成碳酸钠和氧气。
写出方法③反应的文字表达式________。同学们认为③最合适在潜水艇里制氧气,与其他两种方法相比,这种方法的优点是______。
实验二:粗略测定加热2.0g高锰酸钾所收集到的氧气体积。
(9)装置正确连接顺序是:(填接口字母 )a →(________) →(________) →(________)
(10)收集氧气的最佳时机是________________(填“加热后立刻收集”或“加热一段时间后”)。
实验三:小江为了研究用向上排空气法和排水法收集的氧气浓度是否有差异,做了如下实验:加热高锰酸钾固体,分别用两种方法各收集三瓶氧气,并使用传感器则定收集到的氧气浓度,数据见表。
收集方法 | 向上排空气法 | 排水法 | ||||
氧气浓度% | 79.6 | 79.7 | 79.9 | 90.0 | 89.8 | 89.3 |
氧气平均浓度% | 79.7 | 89.7 | ||||
①小江用向上排空气法收集氧气时,以能使在集气瓶瓶口带火星木条复燃为氧气集满的标准;用排水法收集氧气时,以观察到______________________为氧气集满的标准。
②向上排空气法收集到的氧气浓度只有80%左右的原因有_______。
A 当观察到带火星木条复燃时,集气瓶内还有空气
B 氧气的密度略大于空气的密度
C 加热高锰酸钾固体产生氧气的浓度只有80%左右
D 当氧气进入集气瓶时,瓶内空气与进入的氧气相互扩散
③不考虑操作因素,排水法获得的氧气体积分数不能达到100%的主要原因是_____________。