��Ŀ����
����Ŀ��ʵ��������һƿ����ʹ�õ��������ƹ�����Ʒ��ij��ȤС���ͬѧ�Ը���Ʒ�ijɷּ���������̽����
���������⡿����Ʒ�к�����Щ���ʣ�
���������ϡ���NaOH�ڿ����в���ת����NaHCO3��
��BaCl2��Һ�����ԣ�Ba��OH��2�ǿ����Լ�
��CO2�ڱ��͵�NaHCO3��Һ�м������ܽ�
��������롿�����NaOH
�����Na2CO3
�����NaOH��Na2CO3
�����ʵ�顿
ʵ����� | ʵ������ |
| ����٣���Ʒȫ���ܽ� ����ڣ��۲쵽����A |
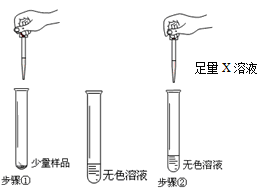
���ռ�֤�ݡ���1��������A�������ݲ�������X��ҺΪ ���� ��������������������������
��2����X��ҺΪBaCl2��Һ������A���а�ɫ�������ɣ�����������Ļ�ѧ����ʽ�� ��ȡ��Ӧ����ϲ���Һ���ⶨ��PH����PH 7�����������������=��������֤������������
������������ȷ�����ֱ�����Ʒ��Na2CO3������������
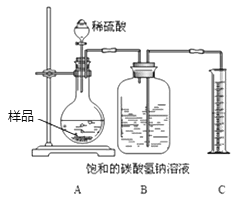
��ȤС���ͬѧ����ͼ��ʾװ�ý���ʵ�飮
�������£��ٰ�ͼ���Ӻ�װ�ã�����������ԣ���ȷ��ȡ����Ʒ1.0g��������ƿ�ڣ��۴������μ�30.0%��ϡ�������������رջ������ܷ�Ӧ��������Ͳ��Һ��Ķ���Ϊ55.0mL������֪�����������£�CO2���ܶ�Ϊ1.6gL��1��
��1��Bװ�ü���ƿ��ԭ�еĿ�����ʵ���� ����С���û�С���Ӱ�죮����NaHCO3��Һ�����ˮ���棬������CO2��� ���ƫ����ƫС�����䡱����
��2���������Ʒ��Na2CO3������������д��������̣�����������һλС����
��ʵ�鷴˼����ͬѧָ�����������ֲ��벢��ȫ�棬�������һ�ֲ��� ��
���𰸡����ռ�֤�ݡ���1��ϡ�����ϡ���� ����1 ��2��Na2CO3+BaCl2==BaCO3��+2NaCl ����
��������������1��û�� ƫС ��2��21.2%
��ʵ�鷴˼��̼���ơ��������ơ�ˮ �� �������ơ�ˮ ��̼���ơ�ˮ
��������
���������
���ռ�֤�ݡ���1������������������еĶ�����̼��Ӧ����̼���ƶ����ʡ�������̼���ƣ������������ϡ�����ϡ������������������ݣ�����1 ��ȷ��
��2������Һ�м����Ȼ�����Һ�����˰�ɫ������˵����Һ�к���̼���ƣ�̼���ƺ��Ȼ�����Ӧ����̼�ᱵ�������Ȼ��ƣ�Na2CO3+BaCl2==BaCO3��+2NaCl���������Ͽ�֪�Ȼ�����Һ�ʼ��ԣ�������������������Һ����ô��Һ��PH����7��
��������������1������Bװ�ü���ƿ��ԭ�еĿ�����ѹǿû��Ӱ�죬�ʶ�ʵ����û��Ӱ�죻����ˮ�л��ܽ�һ�����Ķ�����̼������ˮ���汥�͵�̼��������Һ�ᵼ������Ķ�����̼ƫС��
��2���������⣬���ɵĶ�����̼������=55.0mL��10-3��1.6gL��1=0.088g�����û�ѧ����ʽ�����ݷ�Ӧ�������ȼ��ɼ����̼���Ƶ�������
��̼���Ƶ�����Ϊx��
Na2CO3+H2SO4==Na2SO4+H2O+CO2��
106 44
X 0.088g
106��44 =x��0.088g
X=0.212g
̼���Ƶ���������=0.212g��1g ��100% =21.2%
��ʵ�鷴˼�������������ƹ����׳��⣬�ʿ��ܻ�����ˮ���ʿ�����̼���ơ��������ơ�ˮ��