题目内容
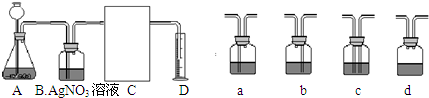
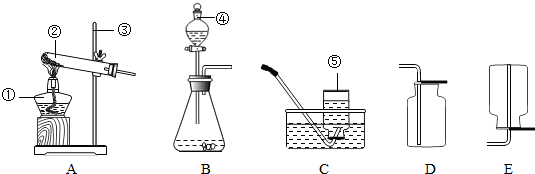
(8分)实验室制取气体的装置如下图,请按要求选择装置井回答下列问题。(学科网精.校)
①装置中a仪器的名称是 ,b仪器的名称是 ;
②实验室用于制取二氧化碳的发生装置和收集装置是 ,发生的化学反应方程式为 。
③利用②的装置还可以制取的气体是 ,发生的化学反应方程式为
。
①试管长颈漏斗②B D CaCO3+2HCl==CaCl2+H2O+CO2 ↑
③O2(氧气)2H202 2H20+O2↑
2H20+O2↑
解析

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
兴化地处里下河地区,河港纵横,水系发达.但河水中含有较多的碳酸氢钙[Ca(HCO3)2],水的硬度较大.(查阅资料:碳酸氢钙易溶于水.当溶有碳酸氢钙的水遇热时,溶解在水里的碳酸氢钙就会发生分解,生成碳酸钙沉积下来,这就形成了水垢Ca(HCO3)2△CaCO3↓+H2O+CO2↑).已知碳酸氢钠、碳酸氢钾、碳酸氢镁等物质均能在加热条件下发生类似的反应.而碳酸钠、碳酸钾则在通常情况下比较稳定,加热不分解.
请你根据上述信息完成下列各题:
(1)根据上述信息可知,水垢的主要成分是 .你能用什么方法来除去水垢?(用化学方程式表示) .
(2)若碳酸镁粉末中混有少量的碳酸氢镁,请写出除去杂质碳酸氢镁的方法(用化学方程式表示) .
(3)实验室有两包质量均为10.6g的固体,分别是碳酸钠和碳酸氢钠.现分别经如下处理:①充分加热 ②滴加足量的稀盐酸 ③将两步反应生成的气体全部收集后通入足量的澄清石灰水.则生成沉淀的质量 (填“相等”、“不相等”或“无法判断”).
(4)在加热条件下密闭容器内发生某一化学反应,现对反应体系内的X、Y、Z、Q四种物质进行测定,测得数据如下:
请回答下列问题:
①上表中的”待测数据”的数值是 .
②此密闭容器内反应类型属于 (填基本反应类型).
③若X是水,Q是能使澄清石灰水变浑浊的气体,且X、Y、Z、Q四种物质的化学计量数之比为1:1:2:1,则物质Y的相对分子质量为 .
(5)实验室制取二氧化碳时若不慎使用了浓盐酸,生成的气体中除混有水蒸气外还可能混有 气体,这是因为浓盐酸具有 性.
现要除去杂质气体,可采用如图所示的装置把不纯的气体进行洗气.
①不纯气体应从 (填“a”或“b”)端通入.
②若只需要把生成的气体干燥,可在瓶中盛放 .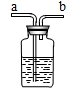
③可在瓶中盛放饱和的碳酸氢钠溶液除去另一种杂质气体.写出有关反应的化学方程式 .
请你根据上述信息完成下列各题:
(1)根据上述信息可知,水垢的主要成分是
(2)若碳酸镁粉末中混有少量的碳酸氢镁,请写出除去杂质碳酸氢镁的方法(用化学方程式表示)
(3)实验室有两包质量均为10.6g的固体,分别是碳酸钠和碳酸氢钠.现分别经如下处理:①充分加热 ②滴加足量的稀盐酸 ③将两步反应生成的气体全部收集后通入足量的澄清石灰水.则生成沉淀的质量
(4)在加热条件下密闭容器内发生某一化学反应,现对反应体系内的X、Y、Z、Q四种物质进行测定,测得数据如下:
| 物质 | X | Y | Z | Q |
| 反应前质量(g) | 40.0 | 4.6 | 37.8 | 0.0 |
| 反应后质量(g) | 43.6 | 待测数据 | 4.2 | 8.8 |
①上表中的”待测数据”的数值是
②此密闭容器内反应类型属于
③若X是水,Q是能使澄清石灰水变浑浊的气体,且X、Y、Z、Q四种物质的化学计量数之比为1:1:2:1,则物质Y的相对分子质量为
(5)实验室制取二氧化碳时若不慎使用了浓盐酸,生成的气体中除混有水蒸气外还可能混有
现要除去杂质气体,可采用如图所示的装置把不纯的气体进行洗气.
①不纯气体应从
②若只需要把生成的气体干燥,可在瓶中盛放

③可在瓶中盛放饱和的碳酸氢钠溶液除去另一种杂质气体.写出有关反应的化学方程式