题目内容
某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成.分四次取样品与稀硫酸反应,其实验数据记录如下表.
| | 1 | 2 | 3 | 4 |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
(2)所用稀硫酸中溶质的质量分数.
65.0% 49.0%
解析试题分析:根据金属与酸反应的条件可知,锌与酸反应,铜与酸不反应.再由表中数据分析可知,第三次反应是合金中的锌反应完了,前两次是酸完全反应,合金有剩余,再正确写出方程式,由方程式求出锌与硫酸的质量,就可以求得黄铜中锌的质量分数和所用稀硫酸中溶质的质量分数.
解:(1)设合金中含锌的质量为x,稀硫酸中含硫酸的质量为y
Zn+H2SO4=ZnSO4+H2↑
65 2
X 1.0g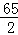 =
=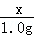
x=32.5g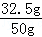 ×100%=65.0%
×100%=65.0%
(2)设稀硫酸中含硫酸的质量为y
Zn+H2SO4=ZnSO4;+H2↑
98 2
y 0.4g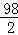 =
=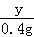
y=19.6g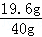 ×100%=49.0%
×100%=49.0%
答:(1)黄铜中锌的质量分数65.0%;
(2)所用稀硫酸中溶质的质量分数为49.0%
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.
点评:解此类题需根据表格内容仔细分析锌与酸哪次反应完全了,这是解题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成,取四份样品分别加稀硫酸反应,其实验数据记录如下表.
试计算:
(1)经分析,在第1份样品测得的数据中, (填物质)完全反应了.
(2)列式计算黄铜屑样品中的锌的质量分数和所用稀硫酸中溶质的质量分数. .
试计算:
| 样品 | 第1份 | 第2份 | 第3份 | 第4份 |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
(2)列式计算黄铜屑样品中的锌的质量分数和所用稀硫酸中溶质的质量分数.
某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成.分四次取样品与稀硫酸反应,其实验数据记录如下表.
试计算:(1)黄铜中锌的质量分数;
(2)所用稀硫酸中溶质的质量分数.
| 1 | 2 | 3 | 4 | |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
(2)所用稀硫酸中溶质的质量分数.
某同学为了测定黄铜屑(由锌和铜形成的合金)样品的组成,取四份样品分别加稀硫酸反应,其实验数据记录如下表.
试计算:
(1)经分析,在第2份样品测得的数据中, (填物质)完全反应了.
(2)列式计算所用稀硫酸中溶质的质量分数.
(3)请在下图中画出在50.0g样品中加稀酸的质量与产生气体质量变化关系的示意图.

| 样 品 | 第1份 | 第2份 | 第3份 | 第4份 |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
(1)经分析,在第2份样品测得的数据中,
(2)列式计算所用稀硫酸中溶质的质量分数.
(3)请在下图中画出在50.0g样品中加稀酸的质量与产生气体质量变化关系的示意图.

某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成,取四份样品分别加稀硫酸反应,其实验数据记录如下表.

试计算:
(1)经分析,在第1份样品测得的数据中, (填物质)完全反应了;
(2)列式计算黄铜屑样品中的锌的质量分数和所用稀硫酸中溶质的质量分数;
(3)请在如图中画出在50.0g样品中加稀硫酸的质量与产生气体质量变化关系的示意图.
| 样 品 | 第1份 | 第2份 | 第3份 | 第4份 |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |

试计算:
(1)经分析,在第1份样品测得的数据中,
(2)列式计算黄铜屑样品中的锌的质量分数和所用稀硫酸中溶质的质量分数;
(3)请在如图中画出在50.0g样品中加稀硫酸的质量与产生气体质量变化关系的示意图.
某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成,取四份样品分别加稀硫酸反应,其实验数据记录如下表.
试计算:
(1)在四份样品所做实验中,稀硫酸有剩余的是 ;
(2)黄铜屑与稀硫酸恰好完全反应时的质量比为 ;
(3)列式计算黄铜样品中铜的质量分数.
| 样品 | 第1份 | 第2份 | 第3份 | 第4份 |
| 取样品质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 取稀硫酸质量(g) | 40.0 | 80.0 | 120.0 | 160.0 |
| 产生气体质量(g) | 0.4 | 0.8 | 1.0 | 1.0 |
(1)在四份样品所做实验中,稀硫酸有剩余的是
(2)黄铜屑与稀硫酸恰好完全反应时的质量比为
(3)列式计算黄铜样品中铜的质量分数.