��Ŀ����
CO2��һ�ֳ����������
��1��CO2����Ӧ��д������Ba��OH��2��Һ��Ӧ�Ļ�ѧ����ʽ��______
��2��CO2�й㷺��;����ҵ�Ͽ���CO2����С�մ�һ�������£����Ȼ�����Һ��ͨ�백����NH3����CO2����������̼�����ƹ��壬��ʱ��Һ����ǣ����ˣ���Һ�к����Ȼ�泥��÷�Ӧ�Ļ�ѧ����ʽ�ǣ���ʾ������ʽ��ƽ�����ʻ�ѧʽǰ�Ļ�ѧ��������Ϊ1��______��
�⣺��1��������̼������������Һ��Ӧ����̼�ᱵ������ˮ����ѧ����ʽΪ��CO2+Ba��OH��2�TBaCO3��+H2O��
��2��������Ϣ��һ�������£����Ȼ�����Һ��ͨ�백����NH3����CO2�����ɴ���Һ������̼�����ƹ��壻���ˣ���Һ��ֻ��̼�����ƺ��Ȼ���������ʡ���֪����Ӧ���Ƕ�����̼��������ˮ���Ȼ��ƣ���������̼�����ƺ��Ȼ�泥�̼�����Ƶ��ܽ�Ƚ�С����Ϊ�������֣����Է���ʽΪ��NaCl+NH3+CO2+H2O=NaHCO3��+NH4Cl��
�ʴ�Ϊ����1��CO2+Ba��OH��2�TBaCO3��+H2O��
��2��NaCl+NH3+CO2+H2O=NaHCO3��+NH4Cl��
��������1��������̼����Ӧ���ɳ�����ˮ��
��2����������Ŀ�е���Ϣ�жϷ�Ӧ����������д������ʽ��
������������Ҫ�������������̼�����ʺ���;��Ҫ��Ƕ�����̼�Ļ�ѧ���ʣ��������ж�����̼����ķ�Ӧ������ѧ����ʽ�ȣ�
��2��������Ϣ��һ�������£����Ȼ�����Һ��ͨ�백����NH3����CO2�����ɴ���Һ������̼�����ƹ��壻���ˣ���Һ��ֻ��̼�����ƺ��Ȼ���������ʡ���֪����Ӧ���Ƕ�����̼��������ˮ���Ȼ��ƣ���������̼�����ƺ��Ȼ�泥�̼�����Ƶ��ܽ�Ƚ�С����Ϊ�������֣����Է���ʽΪ��NaCl+NH3+CO2+H2O=NaHCO3��+NH4Cl��
�ʴ�Ϊ����1��CO2+Ba��OH��2�TBaCO3��+H2O��
��2��NaCl+NH3+CO2+H2O=NaHCO3��+NH4Cl��
��������1��������̼����Ӧ���ɳ�����ˮ��
��2����������Ŀ�е���Ϣ�жϷ�Ӧ����������д������ʽ��
������������Ҫ�������������̼�����ʺ���;��Ҫ��Ƕ�����̼�Ļ�ѧ���ʣ��������ж�����̼����ķ�Ӧ������ѧ����ʽ�ȣ�

��ϰ��ϵ�д�
 ���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д�
���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д� ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д� �ٷ�ѧ����ҵ��������ϵ�д�
�ٷ�ѧ����ҵ��������ϵ�д�
�����Ŀ


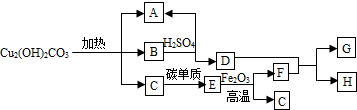
 ����ȸʯ������Ҫ�ɷ��Ǽ�ʽ̼��ͭ[Cu2��OH��2CO3]������һ����Ҫ��ͭ��ʯԭ�ϣ����ȿɷֽ�Ϊ���ֳ����Ļ��������ת����ϵ��ͼ������A�������Һ̬���ʣ�B�Ǻ�ɫ���壬F��GΪ�������ʣ������ƶϻش��������⣺
����ȸʯ������Ҫ�ɷ��Ǽ�ʽ̼��ͭ[Cu2��OH��2CO3]������һ����Ҫ��ͭ��ʯԭ�ϣ����ȿɷֽ�Ϊ���ֳ����Ļ��������ת����ϵ��ͼ������A�������Һ̬���ʣ�B�Ǻ�ɫ���壬F��GΪ�������ʣ������ƶϻش��������⣺