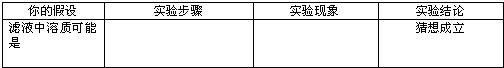
题目内容
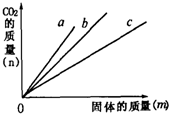 将Na2CO3、CaCO3、MgCO3粉末分别投入足量的盐酸中,如图所示.投入上述三种物质的质量(m)和产生气体的质量(n)间的关系分别为a、b、c三直线,则a、b、c顺序表示的物质是( )
将Na2CO3、CaCO3、MgCO3粉末分别投入足量的盐酸中,如图所示.投入上述三种物质的质量(m)和产生气体的质量(n)间的关系分别为a、b、c三直线,则a、b、c顺序表示的物质是( )分析:根据题目中的反应物、生成物和反应条件,依据化学方程式的书写方法,可以写出Na2CO3、MgCO3、CaCO3分别与足量的盐酸反应的化学方程式;根据化学方程式分别找出Na2CO3、MgCO3、CaCO3与二氧化碳气体的质量比,由Na2CO3、MgCO3、CaCO3的质量可表示出生成的二氧化碳气体质量,然后进行比较即可.
解答:解:(方法一)直接利用化学方程式进行计算,假设Na2CO3、MgCO3、CaCO3的质量都为1g,则:
设1克Na2CO3与足量的盐酸反应,生成的二氧化碳气体的质量为x,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
1g x
=
x=
g
设1克MgCO3与足量的盐酸反应,生成的二氧化碳气体的质量为z.
MgCO3+2HCl═MgCl2+H2O+CO2↑
84 44
1g z
=
z=
g
设1克CaCO3与足量的盐酸反应,生成的二氧化碳气体的质量为a.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
1g a
=
a=
g
根据上述计算可以知道:
g>
g>
g
即等质量的Na2CO3、MgCO3、CaCO3四种物质,分别跟足量稀盐酸反应,产生CO2最多的是MgCO3、CaCO3、Na2CO3;
由图示横坐标取一点做纵坐标的平行线,最多的是碳酸镁、其次是碳酸钙、然后是碳酸钠;
故选A;
方法(二):根据碳元素的质量守恒来完成解答,结合这四种物质与盐酸反应的化学方程式可以知道二氧化碳中的碳元素和碳酸盐中的碳元素的质量相等,而即碳酸盐中碳元素的含量大,那么生成二氧化碳气体的质量就大;设碳酸盐的质量为m,相对分子质量为M,则可以判断碳酸盐中碳元素的质量为:m×
,根据该计算式可以知道,当碳酸盐的质量相等时,该碳酸盐的相对分子质量越小生成的二氧化碳的质量越大,分析所给三种碳酸盐可以知道:M(Na2CO3)=106,M(MgCO3)=84,M(CaCO3)=100,所以可以判断生成二氧化碳气体的质量最大的为碳酸镁,其次是碳酸钙,最少的是碳酸钠;
故选A.
设1克Na2CO3与足量的盐酸反应,生成的二氧化碳气体的质量为x,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
1g x
| 106 |
| 44 |
| 1g |
| x |
x=
| 44 |
| 106 |
设1克MgCO3与足量的盐酸反应,生成的二氧化碳气体的质量为z.
MgCO3+2HCl═MgCl2+H2O+CO2↑
84 44
1g z
| 84 |
| 44 |
| 1g |
| z |
z=
| 44 |
| 84 |
设1克CaCO3与足量的盐酸反应,生成的二氧化碳气体的质量为a.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
1g a
| 100 |
| 44 |
| 1g |
| a |
a=
| 44 |
| 100 |
根据上述计算可以知道:
| 44 |
| 84 |
| 44 |
| 100 |
| 44 |
| 106 |
即等质量的Na2CO3、MgCO3、CaCO3四种物质,分别跟足量稀盐酸反应,产生CO2最多的是MgCO3、CaCO3、Na2CO3;
由图示横坐标取一点做纵坐标的平行线,最多的是碳酸镁、其次是碳酸钙、然后是碳酸钠;
故选A;
方法(二):根据碳元素的质量守恒来完成解答,结合这四种物质与盐酸反应的化学方程式可以知道二氧化碳中的碳元素和碳酸盐中的碳元素的质量相等,而即碳酸盐中碳元素的含量大,那么生成二氧化碳气体的质量就大;设碳酸盐的质量为m,相对分子质量为M,则可以判断碳酸盐中碳元素的质量为:m×
| 12 |
| M |
故选A.
点评:本题主要考查化学方程式的书写和有关化学方程式的计算,计算要细心、准确,并结合图示分析解答.

练习册系列答案
相关题目