题目内容
某工厂每个生产日燃烧含硫质量分数为2%的煤8t,煤中的硫在燃烧中转化成二氧化硫直接排入大气而造成污染.后来工厂进行了技术改造,将二氧化硫通过新技术手段全部截留下来,并按反应方程式2SO2+O2+2H2O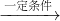 2H2SO4的方法生产硫酸,若将得到的硫酸与氨气反应,又可以生产出化肥硫酸铵.这样既治理了污染,也提高了经济效益,工人们都认识到“污染物其实是放错了地方的资源”.请就此作答:
2H2SO4的方法生产硫酸,若将得到的硫酸与氨气反应,又可以生产出化肥硫酸铵.这样既治理了污染,也提高了经济效益,工人们都认识到“污染物其实是放错了地方的资源”.请就此作答:
(1)132g硫酸铵的含氮量与______g硝酸铵的含氮量相当.
(2)设硫在燃烧中全部转化成二氧化硫,该工厂每年排放的二氧化硫能全部转化成硫酸,经过技术改造后,工厂每年可以生产98%的硫酸多少吨?(请在答卷上列式计算,一年以300个生产日计算)
解:(1)设需要硝酸铵的质量为X,则:132g× ×100%=X×
×100%=X× ×100%,解得X=80g
×100%,解得X=80g
(2)设每年生成98%的硫酸的质量为y,则:
由方程式:S+O2 SO2,2SO2+O2+2H2O
SO2,2SO2+O2+2H2O 2H2SO4可得出以下关系:
2H2SO4可得出以下关系:
S~SO2 ~H2SO4
32 98
300×8t×2% y×98%
根据: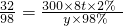 解得y=150t
解得y=150t
答:每年可以生产98%的硫酸150t.
故答案为:(1)80;(2)150t.
分析:(1)132g硫酸铵中氮元素质量就是132g×氮元素在硫酸铵中的质量分数;硝酸铵中氮元素质量就是硝酸铵的质量乘以硝酸铵中氮元素质量分数,二者相等求出硝酸铵的质量;(2)先计算出300个生产日燃烧煤产生硫元素的质量,再计算出二氧化硫的质量,根据方程式计算出硫酸的质量,再除以98%即可.
点评:解答本题关键是要知道元素质量分数的计算方法,根据两个方程式找出两种物质之间的关系式,再进行计算就简单多了.
 ×100%=X×
×100%=X× ×100%,解得X=80g
×100%,解得X=80g(2)设每年生成98%的硫酸的质量为y,则:
由方程式:S+O2
 SO2,2SO2+O2+2H2O
SO2,2SO2+O2+2H2O 2H2SO4可得出以下关系:
2H2SO4可得出以下关系:S~SO2 ~H2SO4
32 98
300×8t×2% y×98%
根据:
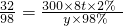 解得y=150t
解得y=150t答:每年可以生产98%的硫酸150t.
故答案为:(1)80;(2)150t.
分析:(1)132g硫酸铵中氮元素质量就是132g×氮元素在硫酸铵中的质量分数;硝酸铵中氮元素质量就是硝酸铵的质量乘以硝酸铵中氮元素质量分数,二者相等求出硝酸铵的质量;(2)先计算出300个生产日燃烧煤产生硫元素的质量,再计算出二氧化硫的质量,根据方程式计算出硫酸的质量,再除以98%即可.
点评:解答本题关键是要知道元素质量分数的计算方法,根据两个方程式找出两种物质之间的关系式,再进行计算就简单多了.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
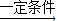 2H2SO4的方法生产硫酸,若将得到的硫酸与氨气反应,又可以生产出化肥硫酸铵.这样既治理了污染,也提高了经济效益,工人们都认识到“污染物其实是放错了地方的资源”.请就此作答:
2H2SO4的方法生产硫酸,若将得到的硫酸与氨气反应,又可以生产出化肥硫酸铵.这样既治理了污染,也提高了经济效益,工人们都认识到“污染物其实是放错了地方的资源”.请就此作答: