题目内容
某工厂每个生产日燃烧含硫质量分数为2%的煤8t,煤中的硫在燃烧中转化成二氧化硫直接排入大气而造成污染.后来工厂进行了技术改造,将二氧化硫通过新技术手段全部截留下来,并按反应方程式2SO2+O2+2H2O
2H2SO4的方法生产硫酸,若将得到的硫酸与氨气反应,又可以生产出化肥硫酸铵.这样既治理了污染,也提高了经济效益,工人们都认识到“污染物其实是放错了地方的资源”.请就此作答:
(1)132g硫酸铵的含氮量与______g硝酸铵的含氮量相当.
(2)设硫在燃烧中全部转化成二氧化硫,该工厂每年排放的二氧化硫能全部转化成硫酸,经过技术改造后,工厂每年可以生产98%的硫酸多少吨?(请在答卷上列式计算,一年以300个生产日计算)
| 一定条件 |
(1)132g硫酸铵的含氮量与______g硝酸铵的含氮量相当.
(2)设硫在燃烧中全部转化成二氧化硫,该工厂每年排放的二氧化硫能全部转化成硫酸,经过技术改造后,工厂每年可以生产98%的硫酸多少吨?(请在答卷上列式计算,一年以300个生产日计算)
(1)设需要硝酸铵的质量为X,则:132g×
×100%=X×
×100%,解得X=80g
(2)设每年生成98%的硫酸的质量为y,则:
由方程式:S+O2
SO2,2SO2+O2+2H2O
2H2SO4可得出以下关系:
S~SO2 ~H2SO4
32 98
300×8t×2% y×98%
根据:
=
解得y=150t
答:每年可以生产98%的硫酸150t.
故答案为:(1)80;(2)150t.
| 28 |
| 132 |
| 28 |
| 80 |
(2)设每年生成98%的硫酸的质量为y,则:
由方程式:S+O2
| ||
| ||
S~SO2 ~H2SO4
32 98
300×8t×2% y×98%
根据:
| 32 |
| 98 |
| 300×8t×2% |
| y×98% |
答:每年可以生产98%的硫酸150t.
故答案为:(1)80;(2)150t.

练习册系列答案
相关题目
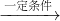 2H2SO4的方法生产硫酸,若将得到的硫酸与氨气反应,又可以生产出化肥硫酸铵.这样既治理了污染,也提高了经济效益,工人们都认识到“污染物其实是放错了地方的资源”.请就此作答:
2H2SO4的方法生产硫酸,若将得到的硫酸与氨气反应,又可以生产出化肥硫酸铵.这样既治理了污染,也提高了经济效益,工人们都认识到“污染物其实是放错了地方的资源”.请就此作答: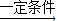 2H2SO4的方法生产硫酸,若将得到的硫酸与氨气反应,又可以生产出化肥硫酸铵.这样既治理了污染,也提高了经济效益,工人们都认识到“污染物其实是放错了地方的资源”.请就此作答:
2H2SO4的方法生产硫酸,若将得到的硫酸与氨气反应,又可以生产出化肥硫酸铵.这样既治理了污染,也提高了经济效益,工人们都认识到“污染物其实是放错了地方的资源”.请就此作答: