题目内容
为测定某盐酸中溶质的质量分数,小荣同学取该盐酸样品50g,向其中加入过量镁粉,反应结束后收集到0.4g氢气,请完成下列计算与分析:
(1)计算该盐酸中溶质质量分数.(写出计算步骤,计算结果精确到0.1%)
(2)小荣将测定结果与盐酸试剂瓶标签上所标的相关信息(浓盐酸、溶质的质量分数为35%)进行对比,发现标签上溶质的质量分数与实际测得的值不符(实验过程无误),你认为原因可能是 .
(1)计算该盐酸中溶质质量分数.(写出计算步骤,计算结果精确到0.1%)
(2)小荣将测定结果与盐酸试剂瓶标签上所标的相关信息(浓盐酸、溶质的质量分数为35%)进行对比,发现标签上溶质的质量分数与实际测得的值不符(实验过程无误),你认为原因可能是
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:根据生成氢气的质量可以计算盐酸中氯化氢的质量,进一步可以计算该盐酸中溶质的质量分数;
浓盐酸易挥发,如果浓盐酸长时间不用,可能会导致质量分数变小.
浓盐酸易挥发,如果浓盐酸长时间不用,可能会导致质量分数变小.
解答:解:(1)设50g盐酸中氯化氢的质量为x,
Mg+2HCl═MgCl2+H2↑,
73 2
x 0.4g
=
x=14.6g
该盐酸中溶质质量分数为:
×100%=29.2%
答:该盐酸中溶质质量分数为29.2%;
(2)因为浓盐酸具有挥发性,溶质氯化氢挥发后会导致溶质质量分数变小.
故填:浓盐酸具有挥发性,溶质挥发后导致溶质质量分数变小.
Mg+2HCl═MgCl2+H2↑,
73 2
x 0.4g
| 73 |
| 2 |
| x |
| 0.4g |
x=14.6g
该盐酸中溶质质量分数为:
| 14.6g |
| 50g |
答:该盐酸中溶质质量分数为29.2%;
(2)因为浓盐酸具有挥发性,溶质氯化氢挥发后会导致溶质质量分数变小.
故填:浓盐酸具有挥发性,溶质挥发后导致溶质质量分数变小.
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,比较简单,计算时要注意规范性和准确性.

练习册系列答案
相关题目
最早发现空气成分的科学家是( )
| A、法国科学家拉瓦锡 |
| B、瑞典化学家舍勒 |
| C、美国化学家普利斯特里 |
| D、英国科学家卡文迪许 |




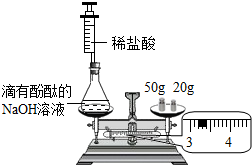 小璐用如图所示装置进行探究实验.
小璐用如图所示装置进行探究实验.
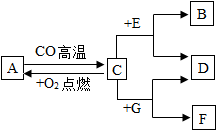 现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为浅绿色溶液,G为蓝色溶液,它们之间存在如图所示关系:
现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为浅绿色溶液,G为蓝色溶液,它们之间存在如图所示关系: