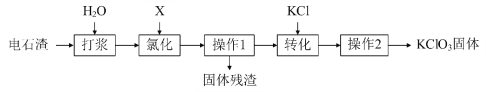
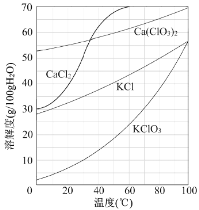
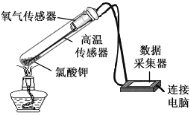
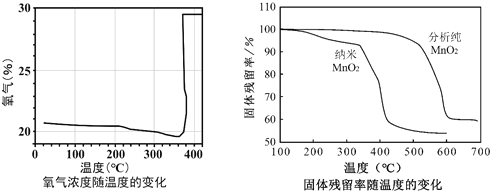
题目内容
【题目】如图是初中化学中常见的实验:
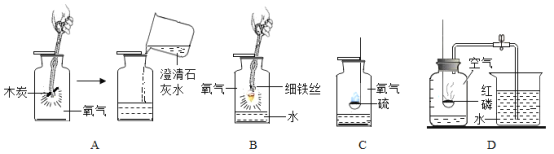
(1)A 中倒入澄清石灰水的目的是____________;
(2)B 中要保证实验成功,需要注意的事项是___________(写一条即可)
(3)C 中水的作用是___________;
(4)D 实验完毕,集气瓶内水面上升到一定高度后,不能继续上升,这种现象说明氮气具有的一种物理性质 是___________; 若从烧杯中进入集气 瓶内水的体积明显小于原空气体积的1/5,可能存在的原因___________(写出一条即可)
【答案】检验木炭燃烧是否生成二氧化碳 铁丝要打磨光亮 吸收反应生成的二氧化硫,防止污染空气 不易溶于水 装置漏气
【解析】
(1)二氧化碳能使澄清石灰水变浑浊。故A 中倒入澄清石灰水的目的是:检验木炭燃烧是否生成二氧化碳;
(2)铁丝燃烧实验中要保证实验成功的注意事项有:铁丝要打磨光亮等合理即可(带火柴快燃尽时,插入盛有氧气的集气瓶中、铁丝要绕成螺旋状、集气瓶底部预先放入少量水等);
(3)硫燃烧实验中水的作用是:吸收反应生成的二氧化硫,防止污染空气;
(4)D 实验完毕,集气瓶内水面上升到一定高度后,不能继续上升,这种现象说明氮气具有的一种物理性质是:不易溶于水;若从烧杯中进入集气瓶内水的体积明显小于原空气体积的1/5,可能存在的原因是:装置漏气等合理即可(红磷量不足;点燃红磷后没有立即伸入集气瓶中并塞紧瓶塞;没有冷却到室温就打开集气瓶)。

【题目】空气是宝贵的自然资源,其组成如下表。
空气组成 | X | O2 | 稀有气体 | CO2 | 其它 |
体积分数 | 78% | Y | 0.94% | 0.03% | 0.03% |
如图是以空气等为原料合成尿素[CO(NH2)2]的流程(部分产物略去)。请按要求回答相关问题:

(1)X 的符号是______ Y 的值是_______
(2)上述流程中煤发生的变化属于_______(填“物理变化”或“化学变化”)
(3)分离空气制取氧气的常用方法有以下两种。
Ⅰ.分离液态空气制氧气,原理是利用液氧和液氮的______不同。
Ⅱ.分子筛分离。分子筛是一种内部分布有均匀微小孔径的固体,通过特制的分子筛把空气中的氧分子吸入孔穴而与其它分子分离,则分子大小:X ______O2(选填“大于“、“等子”、“小于)
(4)结合流程和所学知识可以预测:化学反应中物质发生变化的同时一定还伴随有______(选填“状态”、 “能量”、“原子”、“压强”)变化。