题目内容
【题目】碳在地壳中的含量不高,但它的化合物数量众多,而且分布极广。根据所学知识回答:

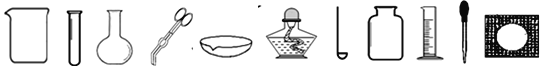
(1)图①为碳原子的结构示意图,碳原子最外层电子数为________,常温下碳的化学性质________,(填“活泼”或“不活泼”)。
(2)图②、③、④对应三种碳单质:图②单质的名称是________,图③单质的名称是________,图④单质的化学式是________。
(3)C为+4价,Cl为-1价,由C和Cl组成的化合物的化学式为________。
(4)实验室若选用图⑤装置制取二氧化碳,则需要改正的一点是________,请你写出用石灰石与稀盐酸反应制取二氧化碳的化学方程式________,将产生的二氧化碳气体通入澄清石灰水,反应的化学方程式是________。
(5)用制取的二氧化碳进行如下实验:
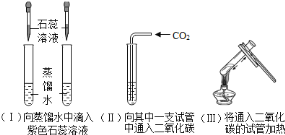
①实验(II)中溶液变________色。
②实脸(III)中加热之后溶液又变为________色,用化学方程式解释出现此现象的原因________。
(6)工业上高温煅烧石灰石(CaCO3)可制得生石灰(CaO)和二氧化碳。如果要制取10t氧化钙,需要碳酸钙多少吨______?
【答案】4 不活泼金刚石石墨C60CCl4改为向上排空气法收集气体CaCO3+2HCl=CaCl2+H2O+CO2↑Ca(OH)2+C02=CaCO3↓+H20红紫H2CO3=H20+CO2↑17.9t
【解析】
(1)碳原子最外层电子数为4,常温下碳的化学性质不活泼。(2)图②的碳原子排列是空间网状结构,具有这种结构的单质是金刚石,图③的碳原子排列是层状结构,具有这种结构的单质是石墨,图④是由60个原子构成的分子,形似足球,具有这种结构的单质的化学式是C60 。(3)化合物中各元素化合价的代数和为零,正价元素符号在前,负价元素符号在后,所以C为+4价,Cl为-1价,由C和Cl组成的化合物的化学式为CCl4。(4)二氧化碳的密度比空气的密度大,收集二氧化碳用向上排空气法。石灰石的主要成分是碳酸钙,与稀盐酸反应生成氯化钙、水、二氧化碳,二氧化碳与澄清石灰水反应生成碳酸钙沉淀和水。(5)①二氧化碳能使紫色石蕊溶液变红。②二氧化碳与紫色石蕊溶液中的水反应生成碳酸,CO2+H2O==H2CO3,碳酸很不稳定,容易分解成二氧化碳和水,H2CO3===CO2↑+H2O,紫色石蕊溶液遇中性物质不变色。(6)设如果要制取10t氧化钙,需要碳酸钙的质量是x。

![]() =
=![]() ,解得x=17.9t
,解得x=17.9t

【题目】小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
(提出猜想)除二氧化锰、氧化铜外,氧化铁也可以作氯酸钾分解的催化剂。
(完成实验)按下表进行测定分解温度(分解温度越低,催化效果越好)。
实验编号 | 实验药品 | 分解温度(℃) |
① | 氯酸钾 | 580 |
② | 氯酸钾、二氧化锰(质量比1:1) | 350 |
③ | 氯酸钾、氧化铜(质量比l:1) | 370 |
④ | 氯酸钾、氧化铁(质量比1:1) | 390 |
(分析数据、得出结论)
(1)由实验__________与实验④对比,证明猜想合理。
(2)实验所用的三种物质,催化效果最好的是_________________。
(反思)
(3)若要证明氧化铁是该反应的催化剂,还要验证它在化学反应前后______________不变;
(4)氯酸钾能被氧化铁催化分解放出氧气的文字表达式为____________ 。
【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是
A | B | C | D | |
实 验 装 置 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
|
解释 | 集气瓶中的水: 吸收放出的热量 | 量筒中的水: 通过水体积的变化得出O2体积 | 集气瓶中的水: 冷却生成物,防止集气瓶炸裂 | 集气瓶中的水: 水先将集气瓶内的空气排净,后便于观察H2何时收集满 |
A. A B. B C. C D. D
【题目】分析处理图表中的信息是学习化学的一种重要方法,运用溶解度表与溶解度曲线回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
NH4Cl溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
NaCl溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
(1)氯化钠的溶解度曲线是 _________(填“甲”或“乙”)。
(2)20℃时,将40g NH4Cl加入100g的水中,充分搅拌后得到的是______溶液(填“饱和”或“不饱和”),将上述溶液升温到30℃,该溶液的溶质质量分数为_______(只列计算式,不需要计算结果)。
(3)如下图,t1℃时,将两种物质的饱和溶液各100g,分别恒温蒸发5g水,析出晶体最多的是______(填“甲”或“乙”)。

(4)计算配制50g质量分数为3%的NaCl溶液所需质量分数为6%的NaCl溶液的体积,需要用到的数据是_____________(填字母)。
A.3%的NaCl溶液的密度 B.水的密度 C.6%的NaCl溶液的密度