题目内容
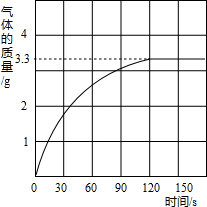 某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢中,产生CO2气体的情况如图所示.
某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢中,产生CO2气体的情况如图所示.(1)从图中可以看出,12.5g水垢与盐酸反应后生成的二氧化碳最多是
(2)水垢中碳酸钙的质量分数是多少?
(3)假设水垢中除碳酸钙和氢氧化镁外,不含有其它杂质,溶解12.5g水垢,至少需要质量分数为10%的盐酸的质量是
分析:(1)从图中可明显看出:折点处即为生成二氧化碳的质量.
(2)根据二氧化碳的质量可求出碳酸钙的质量,再根据
×100%,可求出水垢中碳酸钙的质量分数.
(3)根据水垢的质量和碳酸钙的质量求出氢氧化镁的质量,再根据氢氧化镁的质量求出和氢氧化镁反应的盐酸的质量,根据二氧化碳的质量求出和碳酸钙反应的盐酸的质量,将和氢氧化镁反应的盐酸的质量与和碳酸钙反应的盐酸的质量加起来即为所需盐酸的质量.
(2)根据二氧化碳的质量可求出碳酸钙的质量,再根据
| 碳酸钙的质量 |
| 水垢的质量 |
(3)根据水垢的质量和碳酸钙的质量求出氢氧化镁的质量,再根据氢氧化镁的质量求出和氢氧化镁反应的盐酸的质量,根据二氧化碳的质量求出和碳酸钙反应的盐酸的质量,将和氢氧化镁反应的盐酸的质量与和碳酸钙反应的盐酸的质量加起来即为所需盐酸的质量.
解答:解:(1)从图中可看出生成的二氧化碳最多是3.3g.
(2)设碳酸钙的质量为x.和碳酸钙反应的盐酸溶液中溶质的质量为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
x y 3.3g
=
,x=7.5g
=
,y=5.475g
水垢中碳酸钙的质量分数=
×100%=60%.
答:水垢中碳酸钙的质量分数为60%.
(3)氢氧化镁的质量=12.5g-7.5g=5g
设和氢氧化镁反应的盐酸溶液中溶质的质量为z.
Mg(OH)2+2HCl=MgCl2+2H2O
58 73
5g z
=
,z=6.293g
所需盐酸溶液的质量为
=117.68g≈117.7g
答:至少需要质量分数为10%的盐酸的质量是117.7g
(2)设碳酸钙的质量为x.和碳酸钙反应的盐酸溶液中溶质的质量为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
x y 3.3g
| 100 |
| 44 |
| x |
| 3.3g |
| 73 |
| 44 |
| y |
| 3.3g |
水垢中碳酸钙的质量分数=
| 7.5g |
| 12.5g |
答:水垢中碳酸钙的质量分数为60%.
(3)氢氧化镁的质量=12.5g-7.5g=5g
设和氢氧化镁反应的盐酸溶液中溶质的质量为z.
Mg(OH)2+2HCl=MgCl2+2H2O
58 73
5g z
| 58 |
| 73 |
| 5g |
| z |
所需盐酸溶液的质量为
| 5.475g+6.293g |
| 10% |
答:至少需要质量分数为10%的盐酸的质量是117.7g
点评:本道题的第三小题比较难,做本类型题时应从问题着手分析,逐步向前,直到出现已知条件.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2012?荔湾区一模)某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到10g水垢中,产生CO2气体的情况如图所示.
(2012?荔湾区一模)某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到10g水垢中,产生CO2气体的情况如图所示.  某校化学兴趣小组同学在实验测定一块大理石中碳酸钙的质量分数.他们称取的大理石质量为12.5g,将其放入足量的稀盐酸中,产生气体的情况如图所示.计算该大理石中碳酸钙的质量分数?(大理石中除碳酸钙之外的其它杂质不与盐酸发生反应)
某校化学兴趣小组同学在实验测定一块大理石中碳酸钙的质量分数.他们称取的大理石质量为12.5g,将其放入足量的稀盐酸中,产生气体的情况如图所示.计算该大理石中碳酸钙的质量分数?(大理石中除碳酸钙之外的其它杂质不与盐酸发生反应) 某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢后,产生CO2气体的情况如图所示.
某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢后,产生CO2气体的情况如图所示.