题目内容
【题目】我国化学家侯德榜创立的侯氏制碱法为纯碱工业技术的发展做出了杰出的贡献。
在制备纯碱的过程中涉及NaCl、NH4Cl、NaHCO3等物质。请结合表格数据回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
NaHCO3 | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | |
(1)表中物质中,溶解性属于可溶的物质是_____。
(2)在40℃时,向100g水中加入50gNH4Cl,充分搅拌所得溶液质量为_____g:保持烧杯中各物质质量不变,升温至50℃时,所得溶液溶质的质量分数是_____。
(3)要使20℃时接近饱和的 NaHCO3溶液变成该温度下的饱和溶液,可采用的一种方法是_____。
(4)有一杯60℃的NH4Cl的不饱和溶液(如图A,水为100g),经过如图的变化过程(在整个过程中水分的蒸发忽略不计),请判断:
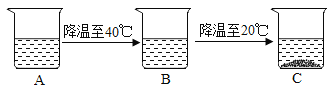
①有关三个烧杯中溶液的下列说法中,正确的是_____(填字母序号)。
a.在变化过程中,溶解度一定发生改变
b.B烧杯中的溶液一定是不饱和溶液
c.由40℃降温至30℃时溶液质量有可能减少
d.A到B的变化过程中,溶液中溶质的质量分数没有发生改变
②A烧杯中溶解的溶质的质量m的范围是_____。
【答案】NaHCO3 145.8 33.3% 加 NaHC03 (或恒温蒸发水分) a、c、d 37.2g<m<45.8g
【解析】
(1)20℃时,溶解度大于1g小于10g的物质属于可溶物质,所以表中二种物质中,溶解性属于可溶的物质是碳酸氢钠;
(2)40℃时,氯化铵的溶解度为45.8g,所以在该温度下,向100g水中加入50gNH4Cl,充分搅拌氯化铵不能完全溶解,所得溶液质量为45.8g+100g=145.8g;保持烧杯中各物质质量不变,升温至50℃时,氯化铵完全溶解,此时所得溶液溶质的质量分数是![]() ×100%≈33.3%;
×100%≈33.3%;
(3)要使20℃时接近饱和的 NaHCO3溶液变成该温度下的饱和溶液,可采用加入碳酸氢钠或蒸发水的方法;
(4)①a、在变化过程中,温度发生了改变,所以溶解度一定发生改变,正确;
b、B烧杯中的溶液可能是饱和溶液,也可能是不饱和溶液,错误;
c、由40℃降温至30℃时溶液质量有可能析出晶体,若析出晶体则溶液质量会减少,若没有晶体析出,溶液质量就不会减少,错误;
d.A到B的变化过程中没有晶体析出,所以溶液中溶质的质量分数没有发生改变,正确;
②A杯为60℃的NH4Cl的不饱和溶液,且降温到40摄氏度时无晶体析出,即其中溶质的质量小于45.8g,降温至20℃时析出部分晶体,则其中溶质的质量大于37.2g。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】碳酸钡广泛应用于显像管(CRT)、陶瓷、光学玻璃等行业。从碳酸盐矿石(主要成分是BaCO3和CaCO3)制备BaCO3的流程如下:
(已知:钡元素化合物的化学性质与钙元素化合物的化学性质相近)
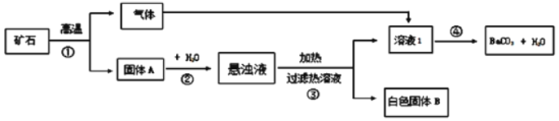
请回答下列问题:
(1)步骤①中产生的气体是_____;步骤③所用的玻璃仪器有玻璃棒、_____、烧杯。
(2)已知不同温度下Ca(OH)2和Ba(OH)2的溶解度如下表:
温度(℃) | 0 | 20 | 25 | 60 |
Ba(OH)2溶解度/g | 1.67 | 3.89 | 5.60 | 20.94 |
Ca(OH)2溶解度/g | 0.189 | 0.173 | 0.148 | 0.121 |
步骤③加热悬浊液,趁热过滤的原因是_____;
(3)现在25℃时,将10g氢氧化钡放入50g水中,充分搅拌,所得溶液的溶质质量分数为_____(结果保留一位小数)。
(4)绿色化学又称环境友好化学,其核心是利用化学原理来减少和消除工业生产对环境的影响。上述流程中体现绿色化学理念的是:_____。
【题目】今年5月9日,由中国科学院等相关部门正式发布了113号、115号、117号、118号元素的中文名称。下表是这四种元素的部分信息,以下有关说法正确的是
原子序数 | 中文名称 | 元素符号 | 汉语拼音 |
113 |
| Nh | nǐ |
115 | 镆 | mò | |
117 |
| Ts | tián |
118 |
| Og | ào |
A. Nh表示![]() 这种物质、
这种物质、![]() 元素、1个
元素、1个![]() 原子
原子
B. 镆的元素符号是 mo
C. ![]() 元素的相对原子质量是 117
元素的相对原子质量是 117
D. ![]() 属于金属元素
属于金属元素